题目内容
8.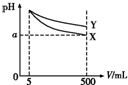 将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )
将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )| A. | 若X、Y都是弱碱,则a的值一定大于9 | |
| B. | 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) | |
| C. | 稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 | |
| D. | 若X、Y是一元碱,则等物质的量浓度的Y的硝酸盐溶液的pH比X的硝酸盐溶液大 |
分析 pH=11的X、Y两种碱溶液稀释100倍后,pH都减小,碱性越强的碱,其pH变化越明显,Y减小的程度小于X,则说明X的碱性大于Y,据此分析解答.
解答 解:pH=11的X、Y两种碱溶液稀释100倍后,pH都减小,碱性越强的碱,其pH变化越明显,Y减小的程度小于X,则说明X的碱性大于Y,
A.若X、Y都是弱碱,加水稀释促进弱电解质电离,所以a的值一定大于9,故A正确;
B.pH相等的两种碱,Y的浓度大于X,所以等体积等PH的两种碱,消耗同浓度稀硫酸的体积V(X)<V(Y),故B错误;
C.碱中氢氧根离子的浓度越大,其抑制水电离程度越大,根据图象中知,Y中氢氧根离子浓度大于X,所以稀释后X溶液中水的电离程度比Y溶液中水电离程度大,故C错误;
D.若X、Y是一元碱,X的碱性大于Y,则Y的阳离子水解程度大于X的阳离子,则等物质的量浓度的Y的硝酸盐溶液的pH比X的硝酸盐溶液小,故D错误;
故选A.
点评 本题考查了弱碱稀释PH变化曲线,明确弱电解质电离特点是解本题关键,根据pH变化大小确定碱相对强弱,再结合离子水解程度来分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
15.体积和pH值都相同的HCl和CH3OOH分别与足量NaHCO3反应,产生CO2的质量( )
| A. | 同样多 | B. | HCl最多 | C. | 醋酸最多 | D. | 无法判断 |
 图所示,则下列化学反应属于阴影部分的是
图所示,则下列化学反应属于阴影部分的是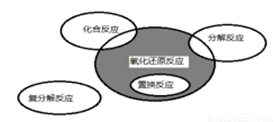
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为18.4mol/L.
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中H2SO4的物质的量浓度为18.4mol/L. 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.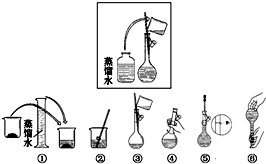 某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.
某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.