题目内容
2.25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
①不考虑其它组实验结果,单从I组实验情况分析,若a=7(填“>”“<”或“=”),则HA为强酸.
②在II组实验的混合溶液中,c(A-)= c(Na+)(填“>”“<”或“=”).
③不考虑其它组实验结果,单从III组实验情况分析,HA是弱酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:HA?H++A-,A-+H2O?HA+OH-.
④IV组实验的混合溶液中,由水电离出的c (OH-)=10-5 mol/L.
分析 ①常温下,强酸弱碱盐溶液呈中性,溶液的pH=7;
②混合溶液呈中性,则溶液中c (OH-)=c (H+),根据电荷守恒判断c(A-)、c(Na+)相对大小;
③二者等体积混合后溶液中溶质为等物质的量浓度的NaA和HA,混合溶液pH>7,溶液呈碱性,说明NaA水解程度大于HA电离程度,则NaA是强碱弱酸盐,溶液呈存在HA电离平衡、NaA水解平衡;
④二者恰好完全反应生成NaA,混合溶液pH=9,溶液呈碱性,由水电离出的c (OH-)=$\frac{{K}_{w}}{c({H}^{+})}$.
解答 解:①常温下,强酸弱碱盐溶液呈中性,溶液的pH=7,如果HA是强酸,则NaA是强酸强碱盐,混合溶液的pH=7,则a=7,故答案为:=;
②混合溶液呈中性,则溶液中c (OH-)=c (H+),根据电荷守恒得c(A-)=c(Na+),故答案为:=;
③二者等体积混合后溶液中溶质为等物质的量浓度的NaA和HA,混合溶液pH>7,溶液呈碱性,说明NaA水解程度大于HA电离程度,则NaA是强碱弱酸盐,所以HA是弱酸,溶液呈存在HA电离平衡、NaA水解平衡,分别为HA?H++A-、A-+H2O?HA+OH-,
故答案为:弱酸;HA?H++A-;A-+H2O?HA+OH-;
④二者恰好完全反应生成NaA,混合溶液pH=9,溶液呈碱性,由水电离出的c (OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5 mol/L,
故答案为:10-5 mol/L.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确混合溶液中溶质成分及其性质是解本题关键,注意结合溶液pH大小分析解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
| A. | 确定过程是否一定会发生 | B. | 判断过程的方向 | ||
| C. | 判断过程发生的速率 | D. | 判断过程的热效应和熵变 |
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
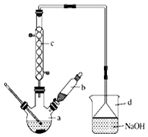 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.再将b中的液溴慢慢加入a中,充分反应.装置a中主要反应:2Fe+3Br2═2FeBr3,
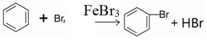 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.(2)反应过程中,a外壁温度升高.为提高原料的利用率,可采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有C6H6、Br2.
②利用温度计控制温度,适宜的温度范围为C(填序号).
A.>156℃B.59℃-80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
步骤②中NaOH溶液洗涤的主要作用是(用化学方程式表示)Br2+2NaOH=NaBr+NaBrO+H2O;
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填序号).
A.分液 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是B(填序号).
A.25mL B.50mL C.250mL D.500mL.
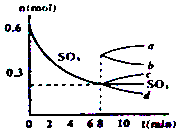 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: