题目内容
13.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为( )| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
分析 H2、CO和铝分别还原等量的MoO3,Mo元素的化合价由+6价降低为0,则得到电子相同,可知还原剂失去电子相同,以此来解答.
解答 解:H2、CO和铝分别还原等量的MoO3,Mo元素的化合价由+6价降低为0,则得到电子相同,
设H2、CO和铝的物质的量分别为x、y、z,则
x×2×(1-0)=y×(4-2)=z×(3-0),
x:y:z=3:3:2,
即所消耗还原剂的物质的量之比为3:3:2,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.孔雀石主要成分为Cu2(OH)2CO3,还含少量铁氧化物和硅氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体流程图:
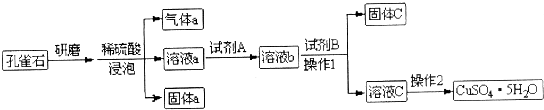
根据实验设计流程和实验目的,判断下列说法中错误的是( )

根据实验设计流程和实验目的,判断下列说法中错误的是( )
| A. | 研磨孔雀石的目的是增大固体表面积,从而加快反应速率 | |
| B. | 试剂A目的是将溶液中Fe2+转化为Fe3+,可选用双氧水作氧化剂 | |
| C. | 试剂B目的是作pH调节剂,使Fe3+转化为沉淀 | |
| D. | 试剂B可以选择NaOH或氨水等碱性试剂 |
4.实验室收集下列气体,不能用排空气法收集的是( )
| A. | H2 | B. | Cl2 | C. | NO | D. | SO2 |
18.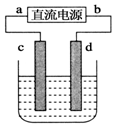 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |
5.对H2O的电离平衡不产生影响的粒子是( )
| A. | HCl | B. | Fe3+ | C. | Cl- | D. | CH3COO- |
2.25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a=7(填“>”“<”或“=”),则HA为强酸.
②在II组实验的混合溶液中,c(A-)= c(Na+)(填“>”“<”或“=”).
③不考虑其它组实验结果,单从III组实验情况分析,HA是弱酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:HA?H++A-,A-+H2O?HA+OH-.
④IV组实验的混合溶液中,由水电离出的c (OH-)=10-5 mol/L.
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
①不考虑其它组实验结果,单从I组实验情况分析,若a=7(填“>”“<”或“=”),则HA为强酸.
②在II组实验的混合溶液中,c(A-)= c(Na+)(填“>”“<”或“=”).
③不考虑其它组实验结果,单从III组实验情况分析,HA是弱酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:HA?H++A-,A-+H2O?HA+OH-.
④IV组实验的混合溶液中,由水电离出的c (OH-)=10-5 mol/L.