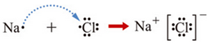题目内容
12.两种气态烃组成的混合气体0.1mol,完全燃烧得到0.16mol CO2和3.6g水,下列说法正确的是( )| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
分析 水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,烃只含C、H元素,由原子守恒可知,烃的平均碳原子为$\frac{0.16mol}{0.1mol}$=1.6,H的平均原子数为$\frac{0.2mol×2}{0.1mol}$=4,平均组成为C1.6H4,以此来解答.
解答 解:A.烃的平均组成为C1.6H4,混合气体中一定有甲烷,故A正确;
B.混合气体中一定有甲烷,可能含乙烯、丙炔,一定不含乙烷,故B错误;
C.一定不含乙烷,H原子数大于4,故C错误;
D.可能含乙烯,故D错误;
故选A.
点评 本题考查有机物分子式计算的确定,为高频考点,把握有机物的燃烧规律、原子守恒为解答的关键,侧重分析与计算能力的考查,注意平均组成的应用,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
3.下列关于化学基本概念和基本理论的几点认识中正确的是( )
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液 |
3.孔雀石主要成分为Cu2(OH)2CO3,还含少量铁氧化物和硅氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体流程图:
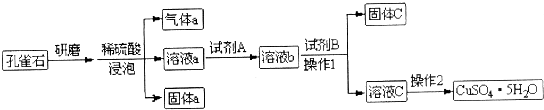
根据实验设计流程和实验目的,判断下列说法中错误的是( )

根据实验设计流程和实验目的,判断下列说法中错误的是( )
| A. | 研磨孔雀石的目的是增大固体表面积,从而加快反应速率 | |
| B. | 试剂A目的是将溶液中Fe2+转化为Fe3+,可选用双氧水作氧化剂 | |
| C. | 试剂B目的是作pH调节剂,使Fe3+转化为沉淀 | |
| D. | 试剂B可以选择NaOH或氨水等碱性试剂 |
20.表为元素周期表的一部分,请回答有关问题:
(1)分别写出⑤的单质和氧化物的一种用途Si作半导体材料,二氧化硅作光纤的材料.
(2)画出表中最活泼的金属阳离子的结构示意图是 ,
,
(3)比较②③⑦三种元素的离子半径大小Cl->F->Mg2+
(4)海水提溴的富集过程是用⑥的一种氧化物与⑩的单质稀溶液反应,达到富集提取的目的,写出该离子方程式SO2+Cl2+2H2O=4H++2Cl-+SO42-
(5)设计一简单实验,比较③和④两种元素金属性的强弱取相同大小的Mg、Al,分别与等浓度的盐酸反应.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
(2)画出表中最活泼的金属阳离子的结构示意图是
 ,
,(3)比较②③⑦三种元素的离子半径大小Cl->F->Mg2+
(4)海水提溴的富集过程是用⑥的一种氧化物与⑩的单质稀溶液反应,达到富集提取的目的,写出该离子方程式SO2+Cl2+2H2O=4H++2Cl-+SO42-
(5)设计一简单实验,比较③和④两种元素金属性的强弱取相同大小的Mg、Al,分别与等浓度的盐酸反应.
7.常温下,pH=8的NaOH溶液与pH=10的KOH溶液等体积混合,溶液的c(H+)为( )
| A. | $\frac{(1{0}^{-8}+1{0}^{-10})}{2}$mol/L | B. | (10-8+10-10)mol/L | ||
| C. | (10-14-5×10-5)mol/L | D. | 2×10-10 mol/L |
4.实验室收集下列气体,不能用排空气法收集的是( )
| A. | H2 | B. | Cl2 | C. | NO | D. | SO2 |
2.25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a=7(填“>”“<”或“=”),则HA为强酸.
②在II组实验的混合溶液中,c(A-)= c(Na+)(填“>”“<”或“=”).
③不考虑其它组实验结果,单从III组实验情况分析,HA是弱酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:HA?H++A-,A-+H2O?HA+OH-.
④IV组实验的混合溶液中,由水电离出的c (OH-)=10-5 mol/L.
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
①不考虑其它组实验结果,单从I组实验情况分析,若a=7(填“>”“<”或“=”),则HA为强酸.
②在II组实验的混合溶液中,c(A-)= c(Na+)(填“>”“<”或“=”).
③不考虑其它组实验结果,单从III组实验情况分析,HA是弱酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:HA?H++A-,A-+H2O?HA+OH-.
④IV组实验的混合溶液中,由水电离出的c (OH-)=10-5 mol/L.