题目内容
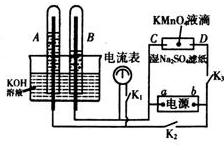 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.(1)写出B中电极反应式
(2)在湿的硫酸钠溶液滤纸条中部的高锰酸钾液滴处发生的现象是
(3)电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针
(4)在298K,若2g B 气体和0.5mol的A 气体完全反应,生成物为液态,放出285?8kJ热量,写出此反应的热化学方程式:
考点:电解原理
专题:电化学专题
分析:A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,AB、CD处是电解原理的应用,依据AB中气体体积变化分析,电解的是水,A端产生氧气,电解池的阳极,B端是氢气,为电解池的阴极,则a为电源的负极,b为电源正极;
(1)根据原电池的工作原理书写电极反应式;
(2)先判断C、D 的电极名称,判断电解时溶液中离子的移动方向;
(3)若电解一段时间,A、B中均有气体包围电极.此时切断K2、K3,闭合K1,电流表的指针偏转,说明AB中形成的氢氧燃料电池,依据原电池原理分析判断;
(4)根据热化学方程式的意义以及书写来回答.
(1)根据原电池的工作原理书写电极反应式;
(2)先判断C、D 的电极名称,判断电解时溶液中离子的移动方向;
(3)若电解一段时间,A、B中均有气体包围电极.此时切断K2、K3,闭合K1,电流表的指针偏转,说明AB中形成的氢氧燃料电池,依据原电池原理分析判断;
(4)根据热化学方程式的意义以及书写来回答.
解答:
解:(1)切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得氢气,A极上得到氧气,所以B极是阴极,A极是阳极,在阴极上产生的是氢气,电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子钾离子向阴极移动,阴离子高锰酸根离子向阳极移动,所以D极呈紫色,故答案为:紫色向D方向移动;
(3)若电解一段时间,A、B中均有气体包围电极切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动,故答案为:是;形成了氢氧燃料电池;
(4)在298K,若2g氢气燃烧生成液态水时放出285.8KJ的热量,则2mol氢气燃烧生成液态水放热571.6KJ,反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△=-571.6KJ/mol,故答案为:2H2(g)+O2(g)=2H2O(l)△=-571.6kJ/mol.
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子钾离子向阴极移动,阴离子高锰酸根离子向阳极移动,所以D极呈紫色,故答案为:紫色向D方向移动;
(3)若电解一段时间,A、B中均有气体包围电极切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动,故答案为:是;形成了氢氧燃料电池;
(4)在298K,若2g氢气燃烧生成液态水时放出285.8KJ的热量,则2mol氢气燃烧生成液态水放热571.6KJ,反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△=-571.6KJ/mol,故答案为:2H2(g)+O2(g)=2H2O(l)△=-571.6kJ/mol.
点评:本题考查了原电池和电解池原理,能正确判断原电池和电解池是解本题关键,知道各个电极上发生的反应,题目难度中等.

练习册系列答案
相关题目
将0.3mol NaCl和0.1mol H2SO4溶于一定量的水中配成溶液,用石墨作电极电解该溶液时,根据电极产物,可分为三个阶段,下列说法正确的是( )
①阴极始终只析出H2
②第一阶段相当于电解NaCl溶液
③第一阶段相当于电解HCl溶液
④第二阶段相当于电解NaCl溶液
⑤第二阶段相当于电解HCl溶液
⑥第三阶段相当于电解Na2SO4溶液.
①阴极始终只析出H2
②第一阶段相当于电解NaCl溶液
③第一阶段相当于电解HCl溶液
④第二阶段相当于电解NaCl溶液
⑤第二阶段相当于电解HCl溶液
⑥第三阶段相当于电解Na2SO4溶液.
| A、①③④⑥ | B、①②④ |
| C、①②④⑥ | D、②④⑤⑥ |
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
| A、CuCl2 (CuO) |
| B、NaOH (NaOH) |
| C、CuSO4 (CuCO3) |
| D、NaCl (NaOH) |
金属镍有广泛应用.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)( )
| A、阳极发生氧化反应,其主要电极反应式:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C、电解后,溶液中存在的金属阳离子有Fe2+,Zn2+和Ni2+ |
| D、电解后,电解槽底部的阳极泥中含有Cu,Pt和Fe |