题目内容
如将容积为50mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽中,足够时间后,量筒里剩余气体体积为5mL.则混合气体中NO2和O2体积比可能是 .
考点:有关混合物反应的计算
专题:计算题
分析:可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,据此解答.
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,据此解答.
解答:
解:NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,对该反应来说,若NO2剩余,则实际是NO,由3NO2+H2O=2HNO3+NO可知,剩余NO气体是5mL,说明剩余的NO2为:5mL×3=15mL,其余的35mL气体中V(NO2):V(O2)=4:1,则混合气体中氧气的体积为:35mL×
=7mL,二氧化氮的体积为:50mL-7mL=43mL,则原混合气体中NO2和O2体积比为:43mL:7mL=43:7;
若剩余气体是O2,则反应的45mL中V(NO2):V(O2)=4:1,原混合气体中二氧化氮的体积为:45mL×
=36mL,氧气为:50mL-36mL=14mL,
则原混合气体中NO2和O2体积比为:36mL:14mL=18:7,
故答案为:若剩余的5mL气体是O2,原混合气体中NO2和O2体积比为18:7;若剩余的5mL气体是NO,原混合气体中NO2和O2体积比为43:7.
| 1 |
| 5 |
若剩余气体是O2,则反应的45mL中V(NO2):V(O2)=4:1,原混合气体中二氧化氮的体积为:45mL×
| 4 |
| 5 |
则原混合气体中NO2和O2体积比为:36mL:14mL=18:7,
故答案为:若剩余的5mL气体是O2,原混合气体中NO2和O2体积比为18:7;若剩余的5mL气体是NO,原混合气体中NO2和O2体积比为43:7.
点评:本题考查了氮氧化物的性质、混合物有关计算,题目难度中等,关键是分析剩余气体的成分,再根据反应的方程式计算,试题培养了学生的分析及化学计算能力

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )

| A、试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
| B、实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
| C、试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
| D、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
聚合硫酸铁(PFS)是一种新型高效的无机高分子净水剂,它的溶液中SO42-与Fe3+物质的量之比不是3:2.为了测定聚合硫酸铁溶液中SO42-与Fe3+物质的量之比需选用的试剂是( )
| A、NaOH |
| B、FeSO4 |
| C、BaCl2 |
| D、NaClO3 |
只用一种试剂可鉴别(NH4)2SO4、NH4Cl、AlCl3、Na2SO4和NaCl五种溶液,这种试剂是( )
| A、NaOH |
| B、HCl |
| C、Ba(OH)2 |
| D、H2SO4 |
今有氧化镁、氧化铝的混合粉末18.2g,将它溶于500ml 4mol?L-1的盐酸里,若要使沉淀质量达到最大植,则需要加入2mol?L-1的氢氧化钠溶液的体积为( )
| A、1000 ml |
| B、500 ml |
| C、100 ml |
| D、1500 ml |
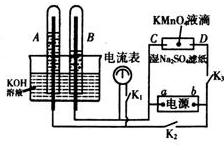 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.