题目内容
有硫酸和盐酸的混合溶液,取出10ml加入足量的BaCl2溶液,可得白色沉淀2.33g,另取这种混合酸液10mL与4mol/LNaOH溶液25mL恰好全部中和.求:
(1)混合溶液中硫酸和盐酸的物质的量浓度是多少?
(2)再取10mL这种混酸溶液,加入足量的锌粉,产生的气体在标准状况下的体积?
(1)混合溶液中硫酸和盐酸的物质的量浓度是多少?
(2)再取10mL这种混酸溶液,加入足量的锌粉,产生的气体在标准状况下的体积?
考点:有关混合物反应的计算
专题:计算题
分析:(1)2.33g白色沉淀为硫酸钡,根据n=
计算出硫酸钡的物质的量,再根据反应H2SO4+BaCl2=2HCl+BaSO4↓计算出硫酸的物质的量;根据硫酸的物质的量计算出硫酸中氢离子的物质的量,再根据氢氧根离子的物质的量计算出盐酸的物质的量,最后根据c=
计算出混合液中硫酸、盐酸的浓度;
(2)10mL混合液中含有氢离子的物质的量 与氢氧化钠的物质的量相等,然后根据氢原子守恒计算出生成氢气的物质的量及标况下的体积.
| m |
| M |
| n |
| V |
(2)10mL混合液中含有氢离子的物质的量 与氢氧化钠的物质的量相等,然后根据氢原子守恒计算出生成氢气的物质的量及标况下的体积.
解答:
解:(1)2.33g沉淀为硫酸钡的质量,则硫酸钡的物质的量为:n(BaSO4)=
=0.01mol,根据反应H2SO4+BaCl2=2HCl+BaSO4↓可知硫酸的物质的量为:n(H2SO4)=n(BaSO4)=0.01mol,则混合液中硫酸的浓度为:c(H2SO4)=
=1mol/L;
另一份10mL的混合液中也含有0.01mol硫酸,0.01mol硫酸电离出0.02mol氢离子;根据酸碱中和反应实质,则盐酸的物质的量为:n(HCl)=n(NaOH)-2n(H2SO4)=4mol/L×0.025L-0.02mol=0.08mol,则混合液中盐酸的浓度为:c(HCl)=
=8mol/L,
答:混合溶液中硫酸和盐酸的物质的量浓度分别为1mol/L、8mol/L;
(2)10mL混合液中含有的氢离子的物质的量为:n(H+)=n(NaOH)=4mol/L×0.025L=0.1mol,
根据氢元素质量守恒可知,生成氢气的物质的量为:n(H2)=
n(H+)=0.05mol,
标况下0.05mol氢气的体积为:22.4L/mol×0.05mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
| 2.33g |
| 233g/mol |
| 0.01mol |
| 0.01L |
另一份10mL的混合液中也含有0.01mol硫酸,0.01mol硫酸电离出0.02mol氢离子;根据酸碱中和反应实质,则盐酸的物质的量为:n(HCl)=n(NaOH)-2n(H2SO4)=4mol/L×0.025L-0.02mol=0.08mol,则混合液中盐酸的浓度为:c(HCl)=
| 0.08mol |
| 0.01L |
答:混合溶液中硫酸和盐酸的物质的量浓度分别为1mol/L、8mol/L;
(2)10mL混合液中含有的氢离子的物质的量为:n(H+)=n(NaOH)=4mol/L×0.025L=0.1mol,
根据氢元素质量守恒可知,生成氢气的物质的量为:n(H2)=
| 1 |
| 2 |
标况下0.05mol氢气的体积为:22.4L/mol×0.05mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
点评:本题考查了混合物反应的计算、离子反应的计算,题目难度中等,注意掌握常见物质之间的反应原理,(2)使用质量守恒计算出氢气的物质的量,可以简化计算步骤.

练习册系列答案
相关题目
100mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48L气体(标准状况),假定电解后溶液体积仍为100mL,下列说法不正确的是( )
| A、原混合溶液中c(K+)=1 mol/L |
| B、上述电解过程中一共转移电子0.8 mol |
| C、电解得到的铜的物质的量为0.2 mol |
| D、电解后溶液中c(H+)=2 mol/L |
下列实验操作中,所用仪器合理的是( )
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
可逆反应N2+3H2?2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到平衡状态的是( )
| A、3V正(N2)=V正(H2) |
| B、V正(N2)=2V逆(NH3) |
| C、2V正(H2)=3V逆(NH3) |
| D、V(N2)=3V(H2) |
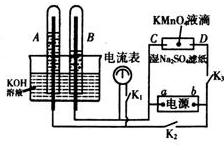 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电. 如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是:
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是: