题目内容
针对下面10种元素,完成以下各小题.
(1)地壳中含量最多的元素是 (填名称).
(2)化学性质最不活泼的元素是 (填元素符号).
(3)Al的原子结构示意图为 .
(4)C与N相比,原子半径较小的是 .
(5)最高价氧化物对应的水化物碱性最强的是 (填化学式).
(6)H2O与H2S中,较不稳定的是
(7)工业上可以用Cl2和H2来制取盐酸,该反应的化学方程式为 .
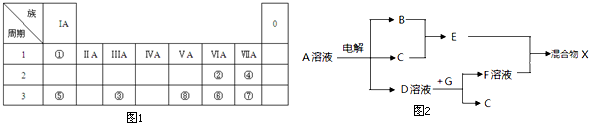
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)化学性质最不活泼的元素是
(3)Al的原子结构示意图为
(4)C与N相比,原子半径较小的是
(5)最高价氧化物对应的水化物碱性最强的是
(6)H2O与H2S中,较不稳定的是
(7)工业上可以用Cl2和H2来制取盐酸,该反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)地壳中含量最多的元素为氧元素;
(2)稀有气体化学性质最不活泼;
(3)Al原子核外电子数为13,有3个电子层,各层电子数为2、8、3;
(4)同周期自左而右原子半径减小;
(5)金属性越强,最高价氧化物对应水化物的碱性越强;
(6)同主族自上而下元素非金属性减弱,非金属性越强,氢化物越稳定;
(7)氯气与氢气反应生成氯化氢.
(2)稀有气体化学性质最不活泼;
(3)Al原子核外电子数为13,有3个电子层,各层电子数为2、8、3;
(4)同周期自左而右原子半径减小;
(5)金属性越强,最高价氧化物对应水化物的碱性越强;
(6)同主族自上而下元素非金属性减弱,非金属性越强,氢化物越稳定;
(7)氯气与氢气反应生成氯化氢.
解答:
解:(1)地壳中含量最多的元素为氧元素,故答案为:氧;
(2)稀有气体Ne的化学性质最不活泼,故答案为:Ne
(3)Al原子核外电子数为13,有3个电子层,各层电子数为2、8、3,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(4)同周期自左而右原子半径减小,故原子半径:C>N,故答案为:N;
(5)同周期自左而右金属性减弱,同主族自上而下金属性增强,上述元素中Na的金属性最强,故NaOH碱性越强,故答案为:NaOH;
(6)同主族自上而下元素非金属性减弱,非金属性越强,氢化物越稳定,故稳定性H2O>H2S,故答案为:H2S;
(7)氯气与氢气反应生成氯化氢,反应方程式为:H2+Cl2
2HCl,故答案为:H2+Cl2
2HCl.
(2)稀有气体Ne的化学性质最不活泼,故答案为:Ne
(3)Al原子核外电子数为13,有3个电子层,各层电子数为2、8、3,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(4)同周期自左而右原子半径减小,故原子半径:C>N,故答案为:N;
(5)同周期自左而右金属性减弱,同主族自上而下金属性增强,上述元素中Na的金属性最强,故NaOH碱性越强,故答案为:NaOH;
(6)同主族自上而下元素非金属性减弱,非金属性越强,氢化物越稳定,故稳定性H2O>H2S,故答案为:H2S;
(7)氯气与氢气反应生成氯化氢,反应方程式为:H2+Cl2
| ||
| ||
点评:本题考查元素周期律、核外电子排布等,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
今有氧化镁、氧化铝的混合粉末18.2g,将它溶于500ml 4mol?L-1的盐酸里,若要使沉淀质量达到最大植,则需要加入2mol?L-1的氢氧化钠溶液的体积为( )
| A、1000 ml |
| B、500 ml |
| C、100 ml |
| D、1500 ml |
下列实验操作中,所用仪器合理的是( )
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
用向下排空气法收集的气体是( )
| A、HCl |
| B、NH3 |
| C、NO |
| D、C12 |
下图所示实验操作正确的是( )
A、 过滤 |
B、 检查装置的气密性 |
C、 金属与酸反应 |
D、 加热液体 |
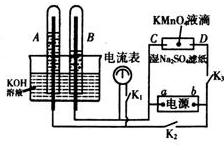 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.