题目内容
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
| A、CuCl2 (CuO) |
| B、NaOH (NaOH) |
| C、CuSO4 (CuCO3) |
| D、NaCl (NaOH) |
考点:电解原理
专题:电化学专题
分析:电解CuCl2溶液时按如下方程式反应:CuCl2
Cu↓+Cl2↑,电解质溶液中每损失1个Cu原子,就同时损失2个Cl原子,相当于损失CuCl2,因而必须再加入适量的CuCl2才能使电解质溶液与原来完全一样,同理可知电解NaOH、NaCl、CuSO4后应分别加入H2O、HCl、CuO,才能使电解质溶液与原来完全一样.
| ||
解答:
解:A.电解CuCl2溶液时一极析铜,另一极产生氯气,应再加入适量的CuCl2才能使电解质溶液与原来完全一样,故A错误;
B.电解NaOH溶液阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,实际上被电解的是水,应加入水才能使电解质溶液与原来完全一样,故B错误;
C.电解CuSO4溶液,阴极Cu2++2e-=Cu,阳极4OH--4e-=O2↑+2H2O,加入CuO或是CuCO3,能使电解质溶液与原来完全一样,故C正确;
D.电解NaCl溶液,2NaCl+2H2O
2NaOH+H2↑+Cl2↑,一极析出氯气,另一极产生氯气,应再加入适量的HCl才能使电解质溶液与原来完全一样,故D错误.
故选C.
B.电解NaOH溶液阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,实际上被电解的是水,应加入水才能使电解质溶液与原来完全一样,故B错误;
C.电解CuSO4溶液,阴极Cu2++2e-=Cu,阳极4OH--4e-=O2↑+2H2O,加入CuO或是CuCO3,能使电解质溶液与原来完全一样,故C正确;
D.电解NaCl溶液,2NaCl+2H2O
| ||
故选C.
点评:本题考查电解原理,题目难度中等,解答本题的关键是能正确判断电极反应,根据析出什么加入什么的原则判断.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )

| A、试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
| B、实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
| C、试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
| D、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
今有氧化镁、氧化铝的混合粉末18.2g,将它溶于500ml 4mol?L-1的盐酸里,若要使沉淀质量达到最大植,则需要加入2mol?L-1的氢氧化钠溶液的体积为( )
| A、1000 ml |
| B、500 ml |
| C、100 ml |
| D、1500 ml |
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是( )
| A、氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| B、氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C、二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
| D、合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率 |
100mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48L气体(标准状况),假定电解后溶液体积仍为100mL,下列说法不正确的是( )
| A、原混合溶液中c(K+)=1 mol/L |
| B、上述电解过程中一共转移电子0.8 mol |
| C、电解得到的铜的物质的量为0.2 mol |
| D、电解后溶液中c(H+)=2 mol/L |
下列实验操作中,所用仪器合理的是( )
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
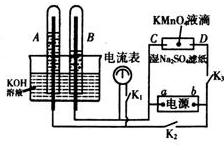 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.