题目内容
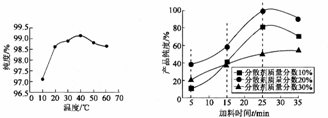
10.两气体a、b分别为0.6mol与0.5mol.在0.4L密闭容器中发生反应2a+b?mc+d,经5min后达到平衡,此时c为0.2mol.又知在此反应期间d的平均反应速率为0.1mol•L-1•min-1,求①m的值为1
②b的转化率为40%
③a的平均反应速率为0.2mol•L-1•min-1.
分析 ①先根据v=$\frac{\frac{△n}{V}}{△t}$计算出平衡时用c表示的反应速率,然后根据反应速率与化学计量数成正比计算出m;
②根据生成c的物质的量计算出消耗b的物质的量,然后可得出b的转化率;
③根据化学反应速率与化学计量数的关系计算出a的平均反应速率.
解答 解:①经5min后达到平衡,此时c为0.2mol,则c的平均反应速率为:v(c)=$\frac{\frac{0.2mol}{0.4L}}{5min}$=0.1mol/(L•min),又知在此反应期间d的平均反应速率为0.1mol•L-1•min-1,根据反应速率与化学计量数成正比可知m:1=0.1mol/(L•min):0.1mol/(L•min),解得:m=1,
故答案为:1;
②平衡时生成0.2molc,根据反应2a+b?c+d可知,反应消耗b的物质的量为0.2mol,则b的转化率为:$\frac{0.2mol}{0.5mol}$×100%=40%,
故答案为:40%;
③在此反应期间d的平均反应速率为0.1mol•L-1•min-1,则a的平衡反应速率为:v(a)=2v(d)=0.1mol•L-1•min-1×2=0.2mol•L-1•min-1,
故答案为:0.2 mol•L-1•min-1.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列有关说法正确的是( )
| A. | 氨水稀释后,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 | |
| D. | 对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
1.建构数学模型来研究化学问题,既直观又简洁.下列建构的数轴模型正确的是( )
| A. | 钠在氧气中燃烧,钠的氧化产物: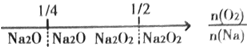 | |
| B. | 铁在Cl2中燃烧,铁的氧化产物: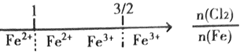 | |
| C. | A1Cl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: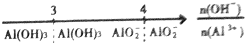 | |
| D. | FeI2溶液中通入Cl2,铁元素存在形式: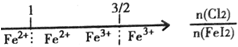 |
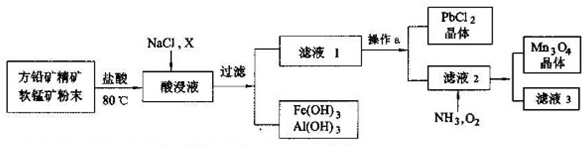
15.硝酸铝是一种常用皮革鞣剂.工业上用铝灰(主要合Al、A12O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3﹒nH2O]的流程如下:
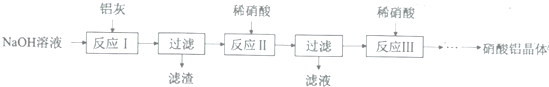
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
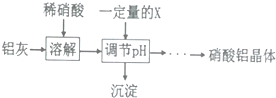
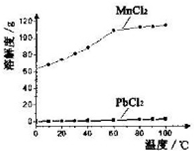
调节pH的目的是将Fe3+转化为Fe(OH)3沉淀除去.为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.

完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |

调节pH的目的是将Fe3+转化为Fe(OH)3沉淀除去.为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.
2.芳香族化合物G与 互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
 互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
20.下列离子方程式中,正确的是( )
| A. | 稀硫酸与NaOH溶液反应:2H++OH-=H2O | |
| B. | AgNO3溶液与NaCl溶液反应:Ag++Cl-=AgCl↓ | |
| C. | CaCO3与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | Fe片插入FeCl3溶液中:Fe+Fe3+=2Fe2+ |