题目内容
1.建构数学模型来研究化学问题,既直观又简洁.下列建构的数轴模型正确的是( )| A. | 钠在氧气中燃烧,钠的氧化产物: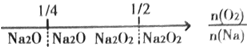 | |
| B. | 铁在Cl2中燃烧,铁的氧化产物: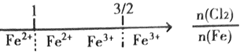 | |
| C. | A1Cl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: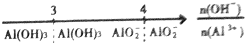 | |
| D. | FeI2溶液中通入Cl2,铁元素存在形式: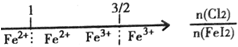 |
分析 A、钠在氧气中燃烧,只生成过氧化钠;
B、铁在Cl2中燃烧,只生成氯化铁;
C、A1Cl3溶液中滴加NaOH溶液,发生的反应为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O;
D、因还原性:I->Fe2+,氯气先氧化I-,再氧化Fe2+,足量的Cl2通入到FeI2溶液中先发生2I-+Cl2=I2+2Cl-,后发生2Fe2++Cl2=2Fe3++2Cl-.
解答 解:A、钠在氧气中燃烧,只生成过氧化钠,故A错误;
B、铁在Cl2中燃烧,只生成氯化铁,故B错误;
C、A1Cl3溶液中滴加NaOH溶液,发生的反应为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O,比值小于3时有铝离子和氢氧化铝,故C错误;
D、因还原性:I->Fe2+,氯气先氧化I-,再氧化Fe2+,足量的Cl2通入到FeI2溶液中先发生2I-+Cl2=I2+2Cl-,后发生2Fe2++Cl2=2Fe3++2Cl-,比值为1时二价铁未被氧化,大于1小于$\frac{3}{2}$时部分二价铁被氧化,大于等于$\frac{3}{2}$时全部被氧化为三价铁离子,故D正确;
故选D.
点评 本题考查了元素化合物的知识,D选项要熟悉碘离子、溴离子、二价铁离子还原性强弱顺序为解体关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列关于化学键的说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 第ⅠA族和第ⅦA族原子化合时,一定生成离子键 | |
| C. | 由非金属元素形成的化合物一定不是离子化合物 | |
| D. | 离子化合物中可能同时含有离子键和共价键 |
9.滴定实验是化学学科中重要的定量实验.请回答下列问题:
Ⅰ.酸碱中和滴定--已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
(1)用酸式滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定-取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
Ⅲ.沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D (填选项字母).
A.NaCl B.NaBr C.NaCN D.Na2CrO4.
Ⅰ.酸碱中和滴定--已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(2)试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定-取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
Ⅲ.沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D (填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
6.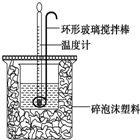 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C (填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D (填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所求中和热相等(填“相等”、“不相等”).
(5)假设50mL 0.50mol•L-1盐酸和50mL 0.55mol•L-1氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容C=4.18J•g-1•℃-1,放出热量计算公式:Q=(m1+m2)•C•(t2-t1).为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热51.8 kJ (结果保留一位小数).
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C (填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D (填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所求中和热相等(填“相等”、“不相等”).
(5)假设50mL 0.50mol•L-1盐酸和50mL 0.55mol•L-1氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容C=4.18J•g-1•℃-1,放出热量计算公式:Q=(m1+m2)•C•(t2-t1).为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
13.乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂.实验室通过乙醇脱水制备:
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$ CH3CH2OCH2CH3+H2O
(170℃时产生CH2=CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
【装置】
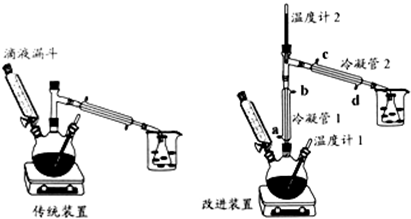
【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏”、“饱和NaCl”溶液).
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$ CH3CH2OCH2CH3+H2O
(170℃时产生CH2=CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |

【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏”、“饱和NaCl”溶液).
11.以下对核外电子运动状况描述正确的是( )
| A. | 能量低的电子只能在s轨道上运动,能量高的电子总在f轨道上运动 | |
| B. | 电子的运动和行星相似,围绕着原子核在固定的轨道上高速旋转 | |
| C. | 同一能层中不同能级的能量高低相同 | |
| D. | M能层中含有3d能级 |