题目内容
请判断下列物质的晶体类型(分子晶体或原子晶体或离子晶体或金属晶体)
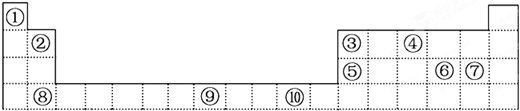
①P4、S8、C60:
②钾、钙、铜:
③硅、金刚石、硼: .
①P4、S8、C60:
②钾、钙、铜:
③硅、金刚石、硼:
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:①由分子构成的物质为分子晶体;
②由金属阳离子与自由电子构成的晶体为金属晶体;
③由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体.
②由金属阳离子与自由电子构成的晶体为金属晶体;
③由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体.
解答:
解:①由分子构成的物质为分子晶体,P4、S8、C60均为分子晶体;故答案为:分子晶体;
②由金属阳离子与自由电子构成的晶体为金属晶体,钾、钙、铜都属于金属晶体,故答案为:金属晶体;
③由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体,硅、金刚石、硼均是由原子构成的原子晶体;
故答案为:原子晶体.
②由金属阳离子与自由电子构成的晶体为金属晶体,钾、钙、铜都属于金属晶体,故答案为:金属晶体;
③由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体,硅、金刚石、硼均是由原子构成的原子晶体;
故答案为:原子晶体.
点评:本题考查晶体的判断,明确不同类型晶体的构成微粒及作用力即可解答,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
对于可逆反应2Fe3++2I-?2Fe2++I2,在25℃时的平衡常数为4×105,则在25℃时某一时刻用仪器测得c(Fe3+)=1×10-4mol?L-1、c(I-)=2×10-4mol?L-1、c(Fe2+)=4×10-3mol?L-1、c(I2)=2×10-4mol?L-1,则平衡如何变化?( )
| A、向左移动 | B、向右移动 |
| C、达平衡状态 | D、无法确定 |
下列过程中△H小于零的是( )
| A、氯酸钾分解制氧气 |
| B、氯化铵受热分解 |
| C、氢气还原氧化铜 |
| D、实验室用锌和稀硫酸反应制氢气 |
 物质结构[Cu(NH3)4]SO4?H2O是一种杀虫剂.
物质结构[Cu(NH3)4]SO4?H2O是一种杀虫剂.