题目内容
14.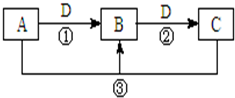 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是FeCl3;实验室制取A的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(4)若D是空气质量预报必报的无色有刺激性气味气体,A、B、C的焰色反应都呈黄色,则B的化学式是Na2SO3.
分析 (1)D是生产、生活中用量最大、用途最广的金属单质,则D是铁,A可用于自来水消毒,A为Cl2,B为FeCl3,C为FeCl2;
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则A是NH3,B为NO,D为O2,C为NO2;
(3)若D的氯碱工业的主要产品,氯碱工业能产生氯气、氢气和氢氧化钠,B有两性,由转化关系可知,A为铝盐,D为NaOH,B为Al(OH)3,C为NaAlO2;
(4)A、B、C的焰色反应都呈黄色,均含有Na元素,D是空气质量预报必报的无色有刺激性气味气体,则D为SO2,A为NaOH,B为Na2SO3,C为NaHSO3.
解答 解:(1)D是生产、生活中用量最大、用途最广的金属单质,则D是铁,A可用于自来水消毒,A为Cl2,B为FeCl3,C为FeCl2,实验室制取氯气方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:FeCl3;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则A是NH3,B为NO,D为O2,C为NO2,反应①的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)若D的氯碱工业的主要产品,氯碱工业能产生氯气、氢气和氢氧化钠,B有两性,由转化关系可知,A为铝盐,D为NaOH,B为Al(OH)3,C为NaAlO2,反应②的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)A、B、C的焰色反应都呈黄色,均含有Na元素,D是空气质量预报必报的无色有刺激性气味气体,则D为SO2,A为NaOH,B为Na2SO3,C为NaHSO3,
故答案为:Na2SO3.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,难度不大,熟练掌握中学常见连续反应.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
| A. | 各物质的浓度之比c(A):c(B):c(C)=2:3:4 | |
| B. | 平衡混合气体中各物质的浓度相等 | |
| C. | 平衡混合气的体积是反应开始前的$\frac{4}{5}$ | |
| D. | 单位时间内,若消耗了a mol A物质,同时也消耗了2a mol C物质 |
| A. | FeS | B. | BaSO3 | C. | BaSO4 | D. | S |
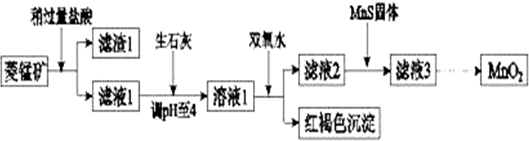
已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①阳极生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度或增大$\frac{c(M{n}^{2+})}{c(C{l}^{-})}$,有利于Mn2+放电(不利于Cl-放电)..
①v(A)=0.15mol/(L•s)
②v(B)=0.6mol/(L•s)
③v(C)=0.5mol/(L•s)
④v(D)=0.45mol/(L•s)
则反应进行由快到慢的顺序为( )
| A. | ④>③>①>② | B. | ④>③>②>① | C. | ②>③>④>① | D. | ②>④>③>① |
| A. | C2H6 | B. | C4H8 | C. | C2H6O | D. | C6H12O6 |
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 反应物的性质是决定反应速率快慢的主要因素 | |
| C. | 相同体积、不同浓度的盐酸分别与大小、形状都相同的铁片反应的速率:1 mol•L-1时<0.1 mol•L-1时 | |
| D. | 在不同温度时,鲜牛奶变酸的速率:28℃时>5℃时 |
