题目内容
9.根据系统命名法,对烷烃 的命名正确的是( )
的命名正确的是( )| A. | 2,4二甲基2乙基己烷 | B. | 3,5,5三甲基庚烷 | ||
| C. | 3,3,5三甲基庚烷 | D. | 3,3,5三甲基-庚烷 |
分析 根据烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
解答 解:依据烷烃命名原则, 名称为:3,3,5-三甲基庚烷,故选C.
名称为:3,3,5-三甲基庚烷,故选C.
点评 本题考查了烷烃命名方法的应用,难度不大,注意主链选择,位置编号的正确选择.

练习册系列答案
相关题目
19.下列关于乙烯(CH2=CH2)的说法正确的( )
| A. | 乙烯分子有1个δ键,1个π键 | |
| B. | 乙烯分子中2个碳原子都是sp3杂化 | |
| C. | 乙烯分子存在非极性键 | |
| D. | 乙烯分子中所有原子都在同一直线上 |
17.下列说法或表示正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 | |
| B. | 由单质A转化为单质B时△H=+119 kJ•mol-1可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在101 kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2在101 kPa时的燃烧热为571.6 kJ•mol-1 |
4.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
14.下列反应中,属于氧化反应的是( )
| A. | 乙烷在光照下与氯气反应 | B. | 乙烯使酸性高锰酸钾溶液褪色 | ||
| C. | 乙烯使溴水褪色 | D. | 苯与液溴混合后撒入铁粉 |
1.可以把6种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液、氢硫酸,区分的试剂是( )
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
18.下列有关实验的叙述正确的是( )
| A. | 用苯萃取碘水中的碘时,将碘的苯溶液从分液漏斗下口放出 | |
| B. | Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | |
| C. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
19.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
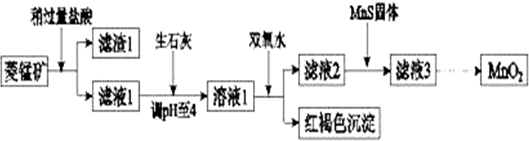
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L,回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①阳极生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度或增大$\frac{c(M{n}^{2+})}{c(C{l}^{-})}$,有利于Mn2+放电(不利于Cl-放电)..

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①阳极生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度或增大$\frac{c(M{n}^{2+})}{c(C{l}^{-})}$,有利于Mn2+放电(不利于Cl-放电)..
 HCOOCH3+H2O
HCOOCH3+H2O