题目内容
12.一个外围电子构型为2s22p5的元素,下列有关它的描述正确的有( )| A. | 原子序数为7 | B. | 周期表中第一电离能最小 | ||
| C. | 周期表中原子半径最大 | D. | 周期表中电负性最大 |
分析 价电子构型为2s22p5的元素,为F元素,为非金属性最强的元素,结合元素周期律的递变规律解答该题.
解答 解:价电子构型为2s22p5的元素,为F元素,
A.原子序数为9,故A错误;
B.在同周期元素中,第一电离能最小的是碱金属元素,故B错误;
C.电子层越多,原子半径越大,F在同周期元素中原子半径最小,故C错误;
D.F的非金属性最强,电负性最打,故D正确.
故选D.
点评 本题考查原子结构与元素周期律,侧重于原子结构与元素周期律的递变规律的考查,难度不大,注意把握元素周期律知识.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
7.下列有关化学用语使用及叙述正确的是( )
| A. | 碳酸的电离方程式:H2CO3=2H++CO32- | |
| B. | F-的结构示意图: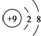 | |
| C. | ${\;}_{55}^{134}$Cs和${\;}_{55}^{137}$Cs形成的单质物理性质相同 | |
| D. | NH3 的电子式: |
17.下列说法或表示正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 | |
| B. | 由单质A转化为单质B时△H=+119 kJ•mol-1可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在101 kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2在101 kPa时的燃烧热为571.6 kJ•mol-1 |
4.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
1.可以把6种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液、氢硫酸,区分的试剂是( )
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
 ,碳氢键之间键角为109°28′.甲烷和氯气在光照下发生取代反应,生成5种产物.产物中CCl4常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:CHBr3+Br2$\stackrel{光照}{→}$CBr4+HBr.
,碳氢键之间键角为109°28′.甲烷和氯气在光照下发生取代反应,生成5种产物.产物中CCl4常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:CHBr3+Br2$\stackrel{光照}{→}$CBr4+HBr.
 HCOOCH3+H2O
HCOOCH3+H2O