题目内容
1.有下列四种有机物①CH2=CHCH2OH②CH3CH2COOH③CH2=CHCOOH④葡萄糖,其中既能发生酯化反应,又能发生加成反应,还能和新制的cu(0H)2悬浊液反应的是( )| A. | ①② | B. | ③④ | C. | ①③ | D. | ①②③ |
分析 能发生酯化反应,有机物中应含有-OH或-COOH,又能发生加成反应,有机物中应含有C=C或-CHO,且能和新制的Cu(OH)2反应,应含有-CHO或-COOH,以此进行解答.
解答 解:①CH2=CHCH2OH含有C=C,可发生加成反应,含有-OH,可发生酯化反应,但不能和新制的Cu(OH)2反应,故①错误;
②CH3CH2CH2OH只含有-OH,只能发生酯化反应,不能发生加成,不能能和新制的Cu(OH)2反应,故②错误;
③CH2=CHCOOH含有C=C,可发生加成反应,含有-COOH,可发生酯化反应,能和新制的Cu(OH)2发生中和反应,故③正确;
④葡萄糖含有-OH,可发生酯化反应,含有-CHO,可发生加成,和新制的Cu(OH)2发生氧化反应,故④正确.
故选B.
点评 本题考查有机物的结构和性质,题目难度不大,注意根据官能团的性质判断有机物可能具有的性质.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
11.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA | |
| B. | 0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA | |
| C. | 1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
16. 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:
(1)生理盐水是质量分数为0.9%的氯化钠溶液,实验室若要配制生理盐水200g,应称取氯化钠固体1.8g,实验中要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管.
(2)在甲、乙、丙三支试管中各放入2gX晶体.再分别加入质量都为10.0g的热水、冷水、酒精,充分搅拌静置后,结果如图所示.
由图实验可知影响物质溶解性的因素有温度、溶剂的种类,实验中若将甲试管溶液降温至t1℃时,溶液恰好饱和,则t1℃时,X的溶解度时20g,若往甲中加入5g水,改变温度至t2℃时,溶液又恰好饱和,则t1>t2(填“>”“<”或“=”).
(3)根据表中提供的信息用结晶的方法分离NaCl和KNO3的混合物,取100g混合物于100g热水中,完全溶解后,冷却至10℃,要得到纯净的KNO3晶体,混合物中KNO3的质量m的取值范围是85.5 g>m>64.2g.
 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:(1)生理盐水是质量分数为0.9%的氯化钠溶液,实验室若要配制生理盐水200g,应称取氯化钠固体1.8g,实验中要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管.
(2)在甲、乙、丙三支试管中各放入2gX晶体.再分别加入质量都为10.0g的热水、冷水、酒精,充分搅拌静置后,结果如图所示.
| 温度/℃ | 10 | 30 | 50 | 70 | |
| 溶解度/g | NaCl | 35.8 | 36.3 | 37.0 | 37.8 |
| KNO3 | 20.9 | 45.8 | 85.5 | 138 | |
(3)根据表中提供的信息用结晶的方法分离NaCl和KNO3的混合物,取100g混合物于100g热水中,完全溶解后,冷却至10℃,要得到纯净的KNO3晶体,混合物中KNO3的质量m的取值范围是85.5 g>m>64.2g.
1.已知液氨的性质与水相似,25℃时,NH3+NH3?NH${\;}_{4}^{+}$+NH${\;}_{2}^{-}$,NH${\;}_{4}^{+}$的平衡浓度为1×10-15mol•L-1,则下列说法中正确的是( )
| A. | 在液氨中加入NaNH2可使液氨的离子积变大 | |
| B. | 在液氨中加入NH4Cl可使液氨的离子积减小 | |
| C. | 在此温度下液氨的离子积为1×10-17 | |
| D. | 在液氨中放入金属钠,可生成NaNH2 |
8.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
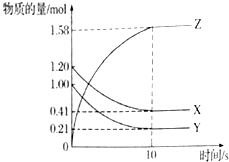 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题: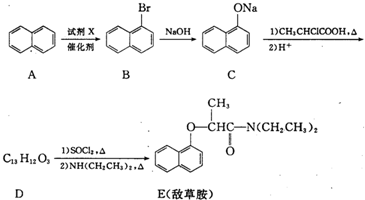
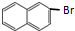 ,试剂X是液溴.
,试剂X是液溴.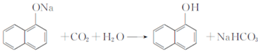 .
.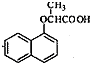 ,由D到E的过程中发生的化学反应类为取代反应.
,由D到E的过程中发生的化学反应类为取代反应.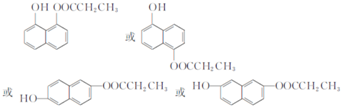 .
.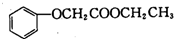 的合成路线图(无机试剂任用).合成路线图示例:
的合成路线图(无机试剂任用).合成路线图示例: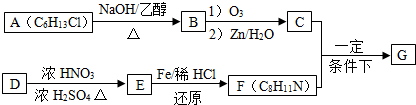


 .
.


 .
.