题目内容
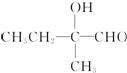
3.下列各组物质中,一定互为同系物的是( )| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. |  和 和  | D. | HCHO、CH3COOH |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.
解答 解:A.乙烷和己烷结构相似,在分子组成上相差4个CH2,属于同系物,故A正确;
B.C3H6O2可能为羧酸或酯,CH3COOH、C3H6O2结构不一定相似,不能确定是否为同系物,故B错误;
C. 和
和  一个是酚,一个是醇,结构不相似,不是同系物,故C错误;
一个是酚,一个是醇,结构不相似,不是同系物,故C错误;
D.醛和羧酸结构不相似,不是同系物,故D错误.
故选A.
点评 本题考查同系物的概念,难度不大,对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1L0.1/L KAl(SO4)2溶液中含有Al3+离子数为0.1NA | |
| B. | 标准状况下,11.2L氦气含有分子数0.5NA | |
| C. | 1mol乙烷分子中含有7NA个共价键 | |
| D. | 32g硫与足量的铜反应,转移电子数2NA |
14.N2的结构可以表示为 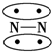 ,CO的结构可以表示为
,CO的结构可以表示为 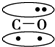 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
 ,CO的结构可以表示为
,CO的结构可以表示为  ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
11.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA | |
| B. | 0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA | |
| C. | 1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
8.如图是Fe(s)+5CO(g)?Fe(CO)5(g)中用CO表示的化学反应速度-时间图象.下列判断不正确的是( )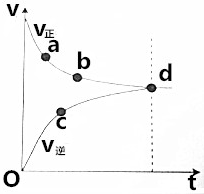

| A. | 起始只投入Fe(CO)5 | |
| B. | d点表示该反应达到限度 | |
| C. | 到达d点后,CO的浓度不变 | |
| D. | 反应过程中,CO的正反应速率逐渐减小 |
8.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
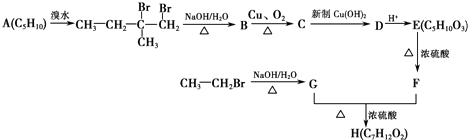
 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$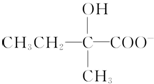 +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.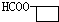 、
、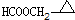 .
. 人们对苯及芳香烃的认识是一个不断深化的过程.
人们对苯及芳香烃的认识是一个不断深化的过程. .
.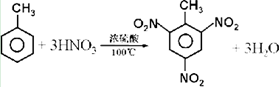 .
.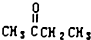 )、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.
)、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.