题目内容
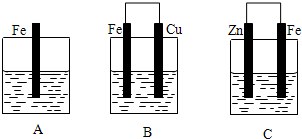
1.下列有关电化学知识的说法正确的是( )| A. | 电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 | |
| B. | 将钢闸门与直流电源的负极相连,可以防止钢闸门腐蚀 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al | |
| D. | 铅蓄电池在充电时,连接电源正极的电极上发生:PbSO4+2e-═Pb+SO42- |
分析 A.根据溶液中减少的元素分析;
B.与电源的负极相连作阴极,被保护;
C.依据阴极阳离子放电顺序解答;
D.电解时阳极上发生失电子的还原反应.
解答 解:A.电解CuSO4溶液,发生的反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,溶液中减少的是Cu和O元素,所以加入适量CuO可以使溶液恢复至原状态,故A错误;
B.与电源的负极相连作阴极,被保护,则将钢闸门与直流电源的负极相连,可以防止钢闸门腐蚀,故B正确;
C.电解CuCl2溶液阴极析出Cu,电解FeCl3析出Fe,电解AlCl3溶液阴极上氢离子得电子能力大于铝离子得电子能力,所以氢离子得电子析出氢气,不是生成Al,故C错误;
D.电解时阳极上发生失电子的还原反应,则铅蓄电池在充电时,连接电源正极的电极上发生:PbSO4+2H2O-2e-═PbO2+SO42-+4H+,故D错误.
故选B.
点评 本题考查了原电池原理和电解池原理,题目难度中等,注意把握电极的判断和电极方程式的书写,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
11.某溶液能与铝反应生成氢气,则该溶液中一定不能够大量共存的离子组是( )
| A. | NH4+、K+、Ba2+、Cl- | B. | Na+、K+、Cl-、S2- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Na+、SO32-、NO3- |
12.下列叙述正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 化学反应中的能量变化与反应物的总能量和生成物的总能量的相对大小无关 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
9.C6H14的烷烃一氯代物种类有( )
| A. | 17种 | B. | 15种 | C. | 12种 | D. | 8种 |
13.工业生产苯乙烯是利用乙苯的脱氢反应:
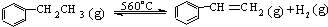 △H>0
△H>0
针对上述反应,有人提出如下观点.其中合理的是( )
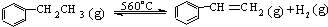 △H>0
△H>0针对上述反应,有人提出如下观点.其中合理的是( )
| A. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大 | |
| D. | 不断分离出苯乙烯可加快反应速率 |
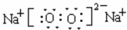 ,ED4的电子式是
,ED4的电子式是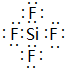 ;
;