题目内容
9.C6H14的烷烃一氯代物种类有( )| A. | 17种 | B. | 15种 | C. | 12种 | D. | 8种 |
分析 先根据减碳法作取代基,利用碳链异构书写C6H14的所有同分异构体,再根据等效氢原子的判断方法确定其其一氯代物的同分异构体数目.
解答 解:C6H14属于烷烃,主链为6个碳原子有:CH3(CH2)4CH3,含有3种等效氢原子,一氯代物的同分异构体有3种,
主链为5个碳原子有:CH3CH2CH2CH(CH3)2,CH3CH2CH(CH3)CH2CH3,前者含有5种等效氢原子,一氯代物的同分异构体有5种,后者含有4种等效氢原子,一氯代物的同分异构体有4种,
主链为4个碳原子有:CH3CH2C(CH3)3,CH3CH(CH3)CH(CH3)CH3,前者含3种等效氢原子,一氯代物的同分异构体有3种,后者含有2种等效氢原子,一氯代物的同分异构体有2种,
则C6H14的烷烃一氯代物种类有3+5+4+3+2=17种,
故选A.
点评 本题考查同分异构体的书写以及一氯代物数目的判断,注意等效氢原子的寻找方法是关键,难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
20.下列说法错误的是( )
| A. | 附着在试管内壁上的AgCl固体可用氨水溶解而洗去 | |
| B. | 可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 | |
| C. | 向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 | |
| D. | 加热碘单质,产生紫色蒸气,这个过程克服了范德华力 |
17.化学在人类生活中扮演着重要角色,以下应用正确的是( )
| A. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| B. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| C. | 食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠 | |
| D. | 太阳能电池板中的硅是二氧化硅,光导纤维的主要成分是硅单质 |
4.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种同分异构体 |
1.下列有关电化学知识的说法正确的是( )
| A. | 电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 | |
| B. | 将钢闸门与直流电源的负极相连,可以防止钢闸门腐蚀 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al | |
| D. | 铅蓄电池在充电时,连接电源正极的电极上发生:PbSO4+2e-═Pb+SO42- |
18.碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),大大地提高了资源利用率,减少了环境污染.
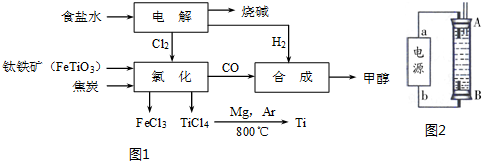
①由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).
已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将向逆反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②写出钛铁矿经氯化得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO.
③若不考虑生产过程中物质的任何损失,该产业链中每合成38.4t甲醇,至少需额外补充H22.0t.
(2)将两个石墨电极插入H2SO4溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8-20e-+6H2O=3CO2+20H+;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图2所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
(1)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),大大地提高了资源利用率,减少了环境污染.

①由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).
已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将向逆反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②写出钛铁矿经氯化得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO.
③若不考虑生产过程中物质的任何损失,该产业链中每合成38.4t甲醇,至少需额外补充H22.0t.
(2)将两个石墨电极插入H2SO4溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8-20e-+6H2O=3CO2+20H+;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图2所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
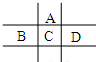 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: