题目内容
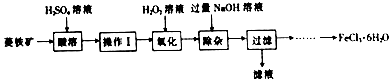
14.铬铁矿的主要成分可以表示为FeO•Cr2O3,还含有SiO2、Al2O3杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)过程如图所示.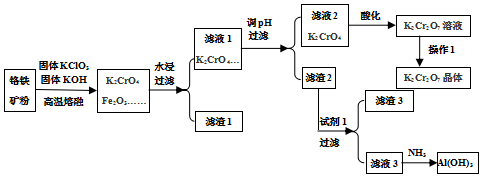
已知:CrO42-和Cr2O72-在酸性条件下可以相互转化.
请回答下列问题:
(1)完成并配平下列方程式:
6FeO+6Cr2O3+24KOH+7KClO3=12K2CrO4+3Fe2O3+7KCl+12H2O
(2)滤渣1的成分是Fe2O3 (填化学式),滤液1的成分除K2CrO4、KClO3、KOH外,还含有KAlO2、K2SiO3(填化学式),过滤后洗涤沉淀的操作是沿玻璃棒注入蒸馏水至浸没沉淀,等蒸馏水自然流下,重复以上操作2-3次.
(3)试剂1是HCl(填化学式),利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,电解时阴极的电极反应式为Al3++3e-=Al.
(4)对滤液2用稀硫酸酸化处理时发生的离子反应方程式是2CrO42-+2H+?Cr2O72-+H2O,酸化处理时往往增大稀硫酸浓度的原因是增大反应物浓度,平衡正向移动,有利于提高产物的产率.
(5)检验氯酸钾晶体中钾元素的具体方法是用洁净的铂丝蘸取待测液,放到酒精灯外焰灼烧,透过蓝色的钴玻璃,观察到紫色火焰证明钾元素存在.
分析 铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质,将铬铁矿和氯酸钾、氢氧化钾高温熔融,发生反应6FeO+6Cr2O3+24KOH+7KClO3=12K2CrO4+3Fe2O3+7KCl+12H2O、2KOH+Al2O3$\frac{\underline{\;高温\;}}{\;}$2KAlO2+H2O、SiO2+2KOH=K2SiO3+H2O,得到K2CrO4、K2SiO3、KAlO2、Fe2O3,然后水浸,过滤得到滤渣1和滤液1,滤渣1为Fe2O3,滤液1中主要是K2CrO4、KClO3、KOH、KAlO2、K2SiO3;调节滤液1的pH,过滤,滤渣2是H2SiO3、Al (OH)3,向其中加入酸,氢氧化铝溶解,H2SiO3不溶,过滤,则滤渣3为H2SiO3,滤液3中有铝离子,通入氨气,生成Al (OH)3沉淀,滤液2主要是K2CrO4,加入酸化,溶质变为K2Cr2O7,将混合溶液蒸发浓缩、冷却结晶得到K2Cr2O7晶体,据此分析.
解答 解:(1)根据质量守恒,方程为:6FeO+6Cr2O3+24KOH+7KClO3=12K2CrO4+3Fe2O3+7KCl+12H2O;
故答案为:24;7;12;3;7;12H2O;
(2)由分析可知,将铬铁矿和氯酸钾、氢氧化钾高温熔融,得到K2CrO4、K2SiO3、KAlO2、Fe2O3,然后水浸,过滤得到滤渣1和滤液1,滤渣1为Fe2O3,滤液1中主要是K2CrO4、KClO3、KOH、KAlO2、K2SiO3;过滤后沿玻璃棒注入蒸馏水至浸没沉淀,等蒸馏水自然流下,重复以上操作2-3次洗涤沉淀;
故答案为:Fe2O3;KAlO2、K2SiO3;沿玻璃棒注入蒸馏水至浸没沉淀,等蒸馏水自然流下,重复以上操作2-3次;
(3)试剂1为酸,可选盐酸,利用滤渣2可得到氧化铝、二氧化硅,电解得金属则电解氧化铝,阴极反应为:Al3++3e-=Al;
故答案为:HCl;Al3++3e-=Al;
(4)对滤液2用稀硫酸酸化处理时发生的离子反应方程式是:2CrO42-+2H+?Cr2O72-+H2O;增大稀硫酸浓度的原因是增大反应物浓度,平衡正向移动,有利于提高产物的产率;
故答案为:2CrO42-+2H+?Cr2O72-+H2O;增大反应物浓度,平衡正向移动,有利于提高产物的产率;
(5)检验钾元素可用焰色反应,方法为:用洁净的铂丝蘸取待测液,放到酒精灯外焰灼烧,透过蓝色的钴玻璃,观察到紫色火焰证明钾元素存在;
故答案为:用洁净的铂丝蘸取待测液,放到酒精灯外焰灼烧,透过蓝色的钴玻璃,观察到紫色火焰证明钾元素存在.
点评 本题考查物质的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.

| A. | $\frac{V}{2}$L | B. | $\frac{V}{3}$L | C. | $\frac{5V}{6}$L | D. | VL |
| A. | NH3 | B. | CO2 | C. | H2 | D. | C2H4 |
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
| A. | 常温下,在$\frac{c(H+)}{c(OH-)}$=1012的溶液中,Fe2+、I-、NO3-、Cl-一定不能大量共存 | |
| B. | H2A是二元弱酸,常温下,0.1mol/LNaHA溶液的pH约为5,说明HA-电离程度大于水解程度 | |
| C. | 使用催化剂一定能够降低化学反应的反应热(△H) | |
| D. | NA为阿伏加德罗常数的值,常温常压下,28gC2H4和C3H6混合气体含有的原子数为6NA |
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
| A. | Na+、I-、K+、Br2 | B. | Mg2+、Cu2+、SO42-、NO3- | ||
| C. | Fe2+、Cl2、K+、SO42- | D. | ClO-、Cl-、CO2、Na+ |