题目内容
6.在下列变化中:①O2溶于水②烧碱熔化③HCl溶于水④Na2O2溶于水.未发生化学键断裂的是①(填序号,以下同);仅发生离子键断裂的是②;仅发生共价键断裂的是③;既发生离子键断裂又发生共价键断裂的是④.
分析 未破坏化学键说明没有发生化学反应或没有电解质熔融或溶于水,物质发生物理变化;仅离子化合物溶于水或熔融或发生化学反应离子键被破坏;仅共价键被破坏说明共价化合物溶于水或发生化学反应;离子键和共价键同时被破坏说明该物质发生化学反应.
解答 解:未破坏化学键说明没有发生化学反应或没有电解质熔融或溶于水,物质发生物理变化,未破坏化学键的是①,仅离子化合物溶于水或熔融或发生化学反应离子键被破坏,所以仅离子键被破坏的是 ②,仅共价键被破坏说明共价化合物溶于水或发生化学反应,所以仅共价键被破坏的是③,离子键和共价键同时被破坏说明该物质发生化学反应,离子键和共价键同时被破坏的是④,故答案为:①、②、③、④.
点评 本题考查了化学键的破坏,明确化学键被破坏的条件是解本题关键,再结合微粒间存在的作用力分析解答,注意:有化学键被破坏不一定发生化学反应,但发生化学反应化学键一定被破坏.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
16.工业制取盐酸是用氯碱工业的氢气和氯气反应后得到HCl气体溶于水制得的,有关制取HCl气体的方法正确的是( )
| A. | 氢气和氯气光照爆炸得到HCl气体 | |
| B. | 在HCl合成塔,点燃的氢气中通入氯气产生HCl | |
| C. | 氯气在空气中点燃后通入氢气产生HCl | |
| D. | 点燃氢气和氯气混合气体产生HCl气体 |
1.下列有机物的命名及名称书写均正确的是( )
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3OOCCH3 乙酸甲酯 | ||
| C. |  硬酯酸甘油脂 硬酯酸甘油脂 | D. | 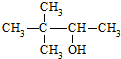 2,2二甲基-3-丁醇 2,2二甲基-3-丁醇 |
15.下列实验正确的是 ( )
| A. | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊,确定NaHCO3溶液中是否混有Na2CO3 | |
| B. | 苯酚沾到皮肤上,先用酒精清洗,再用水冲洗 | |
| C. | 将10g ZnSO4•7H2O溶解在90g水中,配制10%ZnSO4溶液 | |
| D. | 向稀硫酸中加几滴CuSO4溶液,可提高纯锌与稀硫酸的反应速率. |
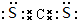 .
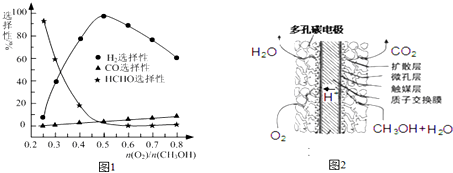
.
 W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图:
W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图: .
.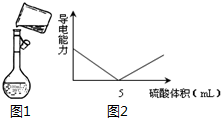 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.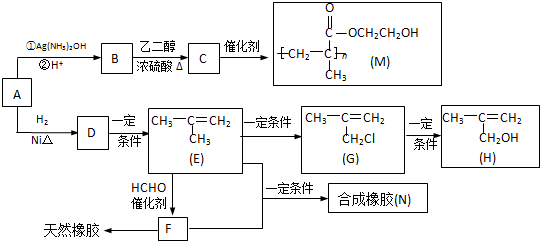
 ;
; .
.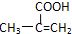 ,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.
,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.