题目内容
10.次磷酸(H3PO2)可发生下列反应而用于化学镀银.4Ag++H3PO2+2H2O═4Ag+H3PO4+4H+试回答下列问题:
(a)H3PO2中,P元素的化合价为+1;该反应中,H3PO2作还原剂(填“氧化剂”或“还原剂”)
(b)用双线桥法标出电子转移的方向和数,并指出氧化剂、还原剂和氧化产物、还原产物.
分析 (a)在一般的化合物中,H元素为+1价、O元素为-2价,各元素化合价的代数和为0,据此判断P元素化合价;得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(b)该反应中Ag元素化合价由+1价变为0价、P元素化合价由+1价变为+5价,转移电子数为4,据此分析解答.
解答 解:(a)在一般的化合物中,H元素为+1价、O元素为-2价,各元素化合价的代数和为0,则P元素化合价为+1价;得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,所以H3PO2做是还原剂,故答案为:+1;还原剂;
(b)该反应中Ag元素化合价由+1价变为0价,则氧化剂为Ag+,生成Ag为还原产物,P元素化合价由+1价变为+5价,则还原剂为H3PO2,生成H3PO4为氧化产物,转移电子数为4,用双线桥法在上式中标出电子转移的数目为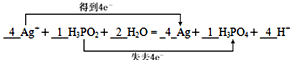 ,故答案为:
,故答案为: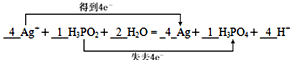 ;氧化剂为Ag+,Ag为还原产物,还原剂为H3PO2,H3PO4为氧化产物.
;氧化剂为Ag+,Ag为还原产物,还原剂为H3PO2,H3PO4为氧化产物.
点评 本题考查氧化还原反应有关知识,为高频考点,涉及氧化还原反应基本概念的判断等知识点,明确化合价变化是解本题关键,题目难度不大.

练习册系列答案
相关题目
20.下列基本实验操作中,不合理的是( )
| A. | 配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm,改用胶头滴管定容 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 用洁净的铂丝蘸取待测液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子 | |
| D. | 分液操作,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
1.把任意比的NaHCO3和Na2O2的混合物放在密闭容器中加热.关于混合物加热前后消耗盐酸的物质的量,下列结论判断正确的是( )
| A. | 加热前后一样多 | B. | 加热前消耗的多 | ||
| C. | 加热后消耗的多 | D. | 当Na2O2适量时才会一样多无法 |
18.下列物质在水溶液中没有漂白作用的是( )
| A. | Cl2 和 NaClO | B. | Na2O2 和 H2O2 | C. | NaOH | D. | SO2和活性炭 |
15.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 再加入10 mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$不变 |
19.苯丙炔酸(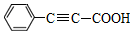 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
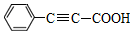 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )| A. | 分子式为C9H7O2 | |
| B. | 与丙炔酸(CH≡C-COOH)互为同系物 | |
| C. | 是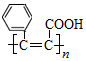 高分子化合物的单体 高分子化合物的单体 | |
| D. | 1 mol苯丙炔酸最多可与4mol氢气发生反应 |
20.下列反应的离子方程式正确的是( )
| A. | 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+═2Fe2+ | |
| B. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-═BaSO4↓+H2O |
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示: