题目内容
4.由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置是( )| A. | 1s2 | B. | 3s23p4 | C. | 2s22p6 | D. | ns2np3 |
分析 A.最外层电子排布为1s2的微粒,可能为He、H-、Li+等;
B.最外层电子排布为3s23p4的微粒为S原子;
C.最外层电子排布为2s22p6的微粒,可能为Ne、Na+、F-等
D.最外层电子排布为ns2np3的微粒,不能确定元素所在周期.
解答 解:A.最外层电子排布为1s2的微粒,可能为He、H-、Li+等,不能确定形成该微粒的元素在周期表中的位置,故A错误;
B.最外层电子排布为3s23p4的微粒为S原子,属于第三周期VIA族,故B正确;
C.最外层电子排布为2s22p6的微粒,可能为Ne、Na+、F-等,不能形成该微粒的元素在周期表中的位置,故C错误;
D.最外层电子排布为ns2np3的微粒,不能确定元素所在周期,不能形成该微粒的元素在周期表中的位置,故D错误,
故选:B.
点评 本题考查核外电子排布、结构与位置关系,关键是熟练掌握常见微粒结构,难度不大,注意利用列举法与反例法进行解答.

练习册系列答案
相关题目
14.在无色溶液中,下列各组离子可能大量共存的是( )
| A. | OH-、NO3-、HCO3-、Na+ | B. | Na+、SO42-、Mg2+、I- | ||
| C. | NO3-、Cu2+、K+、Cl- | D. | H+、K+、ClO-、Ba2+ |
15.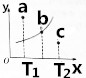 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
(1)用物质的A表示的反应的平均速率为0.3mol/L•s.
(2)2s时物质A的转化率为30%.
(3)图中的曲线是该反应在不同温度下的平衡曲线,x中表示温度,y轴表示B的转化率,图中有a、b、c三点,
①该反应是吸热(填“吸热”或“放热”)反应;
②C点:v正>v逆(填“>”、“<”或“=”).
(4)一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入A和B,其起始物质的量及A的平衡转化率如下表所示:
①该温度下,乙中反应的平衡常数K为400;
②A的平衡转化率:α2>α1(填“>”、“<”或“=”);
③容器中C的物质的量浓度:甲<丁(填“>”、“<”或“=”).
 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:| 密闭容器 | A | B | C |
| n(起始状态)/mol | 4 | 2 | 0 |
| n(平衡状态)/mol | 2.8 | 1.4 | 1.2 |
(2)2s时物质A的转化率为30%.
(3)图中的曲线是该反应在不同温度下的平衡曲线,x中表示温度,y轴表示B的转化率,图中有a、b、c三点,
①该反应是吸热(填“吸热”或“放热”)反应;
②C点:v正>v逆(填“>”、“<”或“=”).
(4)一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入A和B,其起始物质的量及A的平衡转化率如下表所示:
| 密闭容器 | 甲 | 乙 | 丙 | 丁 | |
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| A的平衡转化率 | 80 | α1 | α2 | α3 | |
②A的平衡转化率:α2>α1(填“>”、“<”或“=”);
③容器中C的物质的量浓度:甲<丁(填“>”、“<”或“=”).
12.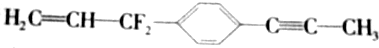 为已知结构,下列叙述中正确的是( )
为已知结构,下列叙述中正确的是( )
 为已知结构,下列叙述中正确的是( )
为已知结构,下列叙述中正确的是( )| A. | 除苯环外的其余碳原子有可能都在同一条直线上 | |
| B. | 在同一平面上的原子最多有19个 | |
| C. | 12个碳原子不可能都在同一个平面上 | |
| D. | 12个碳原子有可能都在同一个平面上 |
19.下列化合物结构中有两种常见官能团的是( )
| A. | HOCH2CH2Cl | B. | CH3CH2OH | C. | CH3COOH | D. | 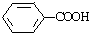 |
9.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,下列有关叙述正确的是( )
| A. | D元素处于元素周期表中第二周期VIA族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
16.下列元素-定为主族元素的是( )
| A. | 其原子最外电子层有7个电子的元素 | |
| B. | 最高正价为+3的元素 | |
| C. | 其原子最外层电子数大于电子层的元素 | |
| D. | 最高价氧化物对应的水化物是酸的元素 |
14.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
①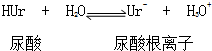 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)
下列对反应②叙述中正确的是( )
①
 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)下列对反应②叙述中正确的是( )
| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
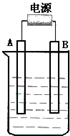 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: