题目内容
11.下列操作所得结论正确的是( )| 选项 | 实验操作 | 结论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所得溶液的pH偏大 |
| C | 不断通入HCl的条件下,将TiCl4溶液蒸发浓缩、降温结晶 | 可以得到更纯净的TiCl4固体 |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.再加水至刻度线,导致溶液的体积偏大;
B.次氯酸具有漂白性;
C.TiCl4易水解;
D.左盘放砝码右盘放NaCl,所称量氯化钠的质量偏小.
解答 解:A.若定容后摇匀液面低于刻度线,再加水至刻度线,导致溶液的体积偏大,配制溶液的浓度偏小,故A错误;
B.氯气和水反应生成的次氯酸具有漂白性,会导致测定的pH不准确,故B错误;
C.TiCl4易水解,通入HCl可抑制水解,故C正确;
D.在用托盘天平称量所需NaCl的质量时,左盘放砝码右盘放NaCl,所称量氯化钠的质量偏小,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液配制、pH测定、盐类水解以及托盘天平使用等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
1.根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | Ka=3×10-8 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 |
| A. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | B. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) | ||
| C. | c(HCO3-)>c(ClO-)>c(OH-) | D. | c(ClO-)>c(HCO3-)>c(H+) |
2.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
19.下列化合物结构中有两种常见官能团的是( )
| A. | HOCH2CH2Cl | B. | CH3CH2OH | C. | CH3COOH | D. | 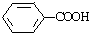 |
6.下列关于铷(Rb)的叙述中,正确的是( )
| A. | 铷的密度比钠小,熔点比钠高 | |
| B. | 铷与冷水不反应,但与热水反应,并放出氢气 | |
| C. | 铷盐大多数易溶于水 | |
| D. | 铷的原子半径和离子半径都比钠小 |
16.下列元素-定为主族元素的是( )
| A. | 其原子最外电子层有7个电子的元素 | |
| B. | 最高正价为+3的元素 | |
| C. | 其原子最外层电子数大于电子层的元素 | |
| D. | 最高价氧化物对应的水化物是酸的元素 |
4.下列关于铜电极的叙述中,正确的是( )
| A. | 电解稀硫酸制H2、O2时铜作阳极 | B. | 用电解法精炼粗铜时粗铜作阴极 | ||
| C. | 在镀件上电镀铜时用金属铜作阴极 | D. | 铜锌原电池中铜是正极 |
1.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
| A. | 用Cu作阴、阳电极,电解CuCl2溶液 | |
| B. | 用Cu作阴、阳电极,电解K2SO4溶液 | |
| C. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| D. | Cu作原电池的负极,碳棒作正极,NaCl溶液作电解质溶液 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |