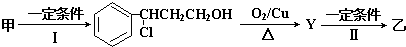题目内容
如图:V(NO):V(O2)═3:1.当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态).当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm.假设温度不变,且隔板及U形毛细管的体积都忽略不计,求此时混合气体的平均相对分子质量.
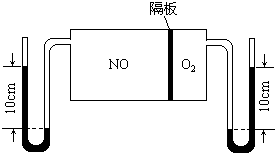

考点:化学平衡的计算
专题:化学平衡专题
分析:设出一氧化氮和氧气的物质的量及二氧化氮的转化率,然后根据
=
列式计算出二氧化氮转化率,最后计算出混合气体的平均相对分子质量.
| P(平衡) |
| P(起始) |
| n(平衡) |
| n(起始) |
解答:
解:设反应前NO为3 mol,O2为1 mol,NO2转化率为x
则:2NO+O2 =2NO2,
2 1 2
2mol 1mol 2mol
平衡时二氧化氮的物质的量为2x,
则:2NO2 ?N2O4,
反应前:2mol 0
转化:2xmol xmol
平衡时:2(1-x)mol xmol
平衡时气体的总物质的量为:n(NO)+n(NO2)+n(N2O4)=1mol+2mol-2xmol+xmol=(3-x)mol,
所以T、V恒定时,根据
=
,
则
=
,
解得:x=0.16,平衡时气体的总物质的量为:3mol-0.16mol=2.84mol,
所以混合气体的平均相对分子质量
=
=42.9,
答:此时混合气体的平均相对分子质量为42.9.
则:2NO+O2 =2NO2,
2 1 2
2mol 1mol 2mol
平衡时二氧化氮的物质的量为2x,
则:2NO2 ?N2O4,
反应前:2mol 0
转化:2xmol xmol
平衡时:2(1-x)mol xmol
平衡时气体的总物质的量为:n(NO)+n(NO2)+n(N2O4)=1mol+2mol-2xmol+xmol=(3-x)mol,
所以T、V恒定时,根据
| P(平衡) |
| P(起始) |
| n(平衡) |
| n(起始) |
则
| 3-x |
| 4 |
| 7.1 |
| 10 |
解得:x=0.16,平衡时气体的总物质的量为:3mol-0.16mol=2.84mol,
所以混合气体的平均相对分子质量
. |
| M |
| 3×30+1×32 |
| 2.84 |
答:此时混合气体的平均相对分子质量为42.9.
点评:本题涉及化学平衡的计算,题目难度较大,是对学生心理素质的考验,注意掌握平衡常数在化学平衡计算的运用,注意掌握计算方法.

练习册系列答案
相关题目
下列有关物质的性质和该性质的应用均正确的是( )
| A、晶体硅具有半导体性质,可用于生产光导纤维 |
| B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、二氧化硫具有漂白性,铵不可用于食品漂白 |
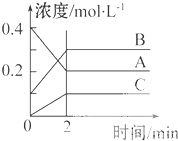 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A、发生的反应可表示为:2A(g)?2B(g)+C(g) |
| B、前2 min A的分解速率为0.1mol?L-1?min-1 |
| C、开始时,正逆反应同时开始 |
| D、2 min时,A、B、C的浓度之比为2:3:1 |
一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)( )
| A、1mol/L |
| B、2mol/L |
| C、4mol/L |
| D、8mol/L |
下列说法不正确的是( )
| A、增大反应物浓度,可增大单位体积内活化分子总数,从而使有效碰撞次数增大 |
| B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C、升高温度能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
| D、催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大反应速率 |
 (1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为