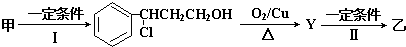题目内容
工业上合成氨的化学反应N2(g)+3H2(g)?2NH3(g)△=-92.4kJ/mol、△s=-98.3J/(mol?K),在容积为10L的密闭容器中,通入4mol N2和12mol H2,在一定条件下进行反应,4s后达到平衡状态,此时N2的浓度为0.2mol/L.试通过计算回答下列问题:
(1)温度为500K时,该反应 (填“能”或“不能”自发进行);反应进行到平衡状态时△H-T△S= .
(2)用N2表示的4s内化学反应的平均速率是 .
(3)该条件下N2的最大转化率为 ,此时混合气体中NH3的体积分数是 .
(4)为了提高氨气的产率,可以选择的方法是 (填序号多选,少选不得分)
①升高温度②增大压强③使用催化剂④及时分离出NH4.
(1)温度为500K时,该反应
(2)用N2表示的4s内化学反应的平均速率是
(3)该条件下N2的最大转化率为
(4)为了提高氨气的产率,可以选择的方法是
①升高温度②增大压强③使用催化剂④及时分离出NH4.
考点:化学平衡的影响因素,反应速率的定量表示方法
专题:化学平衡专题,化学反应速率专题
分析:(1)△G=△H-T△S<0时,反应能够自发进行,据此分析;
(2)根据n=cV计算出达到平衡时氮气的物质的量,据v=
求反应速率;
(3)分别计算出氮气的转化率、混合气体中氨气的体积分数;
(4)根据温度、压强对化学平衡的影响进行解答.
(2)根据n=cV计算出达到平衡时氮气的物质的量,据v=
| △c |
| △t |
(3)分别计算出氮气的转化率、混合气体中氨气的体积分数;
(4)根据温度、压强对化学平衡的影响进行解答.
解答:
解:(1)△G=△H-T△S=-92.4×1000J/mol-[-98.3J/(mol?K)]×500K=-43250kJ/mol<0,所以该反应能够自发进行;△H-T△S=0时反应达到平衡状态,
故答案为:能;0;
(2)达到平衡时N2的浓度为0.2mol/L,平衡时氮气的物质的量为:n(N2)=0.2mol/L×10L=2mol,达到平衡时消耗氮气的物质的量为:4mol-2mol=2mol,
N2(g)+3H2(g)═2NH3(g)△n
1 3 2 2
起始量(物质的量) 4 12 0
转化量(物质的量) 2 6 4 4
平衡量(物质的量) 2 6 4 4
v(N2)=
=0.05mol/(L?s),故答案为:0.05mol/(L?s);
(3)n(NH3)=4mol,该条件下N2的最大转化率为:
×100%=50%;
此时混合气体中NH3的体积分数是:
×100%=25%;
故答案为:50%;25%;
(4)要提高氨的产率,需要使平衡向着正向移动,该反应为放热、气体体积减小的可逆反应,则低温、高压条件下有利于平衡向着正向移动,及时分离出氨气,有利于提高氨气的产率,
故答案为:②④.
故答案为:能;0;
(2)达到平衡时N2的浓度为0.2mol/L,平衡时氮气的物质的量为:n(N2)=0.2mol/L×10L=2mol,达到平衡时消耗氮气的物质的量为:4mol-2mol=2mol,
N2(g)+3H2(g)═2NH3(g)△n
1 3 2 2
起始量(物质的量) 4 12 0
转化量(物质的量) 2 6 4 4
平衡量(物质的量) 2 6 4 4
v(N2)=
| ||
| 4s |
(3)n(NH3)=4mol,该条件下N2的最大转化率为:
| 2mol |
| 4mol |
此时混合气体中NH3的体积分数是:
| 4mol |
| 2mol+6mol-4mol |
故答案为:50%;25%;
(4)要提高氨的产率,需要使平衡向着正向移动,该反应为放热、气体体积减小的可逆反应,则低温、高压条件下有利于平衡向着正向移动,及时分离出氨气,有利于提高氨气的产率,
故答案为:②④.
点评:本题考查了化学反应速率、化学平衡的影响因素、化学平衡的计算等知识,题目难度中等,注意掌握影响化学反应速率、化学平衡的因素,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列叙述错误的是( )
| A、标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5×6.02×1023个 |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度 |
| D、同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11 |
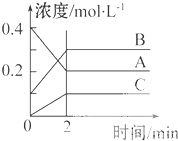 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A、发生的反应可表示为:2A(g)?2B(g)+C(g) |
| B、前2 min A的分解速率为0.1mol?L-1?min-1 |
| C、开始时,正逆反应同时开始 |
| D、2 min时,A、B、C的浓度之比为2:3:1 |
银锌电池广泛用作各种电子仪器的电源,其充电和放电过程可以表示为:Ag2O+Zn+H2O
2Ag+Zn(OH)2,电池放电时,负极上发生反应的物质及电池充电时阴极发生反应的物质分别是( )
| 充电 |
| 放电 |
| A、Zn、Zn(OH)2 |
| B、Ag、Ag2O |
| C、Ag2O、Zn |
| D、Zn(OH)2、Ag2O |

 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.