题目内容
(1)2mol O3和3molO2的质量 (填“相等”“不相等”或“无法判断”);分子数之比为 ;原子数之比为 ;在相同条件下的体积之比为
(2)等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
(3)所贴标签为7%(密度为1.043g?mL-1)的盐酸中溶质的物质的量浓度
(4)相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为dg?cm-3,则该饱和溶液中溶质的物质的量浓度为 .
(2)等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
(3)所贴标签为7%(密度为1.043g?mL-1)的盐酸中溶质的物质的量浓度
(4)相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为dg?cm-3,则该饱和溶液中溶质的物质的量浓度为
考点:物质的量的相关计算
专题:计算题
分析:(1)根据m=nM计算O2和O3的质量,进而比较二者质量的大小;根据数目之比等于物质的量之比;根据O3和O2的物质的量以及分子的组成来计算原子的物质的量,原子数目之比等于物质的量之比;同温同压下体积之比等于物质的量之比;
(2)生成硫酸钡沉淀的质量比为1:2:3,即生成硫酸钡的物质的量之比为1:2:3,然后利用Al2(SO4)3~3BaSO4↓、ZnSO4~BaSO4↓、Na2SO4~BaSO4↓来计算;
(3)根据C=
计算;
(4)根据饱和溶液的溶解度S可以计算出溶液中溶质的质量分数ω=
,然后根据溶质质量分数与物质的量浓度的关系c=
计算出该饱和溶液的物质的量浓度.
(2)生成硫酸钡沉淀的质量比为1:2:3,即生成硫酸钡的物质的量之比为1:2:3,然后利用Al2(SO4)3~3BaSO4↓、ZnSO4~BaSO4↓、Na2SO4~BaSO4↓来计算;
(3)根据C=
| 1000ρw |
| M |
(4)根据饱和溶液的溶解度S可以计算出溶液中溶质的质量分数ω=
| S |
| 100+S |
| 1000ρw |
| M |
解答:
解:(1)2molO3的质量为2mol×48g/mol=96g,3molO2的质量为3mol×32g/mol=96g,故二者质量相等;2molO3和3molO2的数目之比等于物质的量之比,即分子数之比为2mol:3mol=2:3;2molO3中
=原子的物质的量为2mol×3=6mol,3mol O2的中原子的物质的量为3mol×2=6mol,所含氧原子的数目之比为6mol:6mol=1:1;同温同压下体积之比等于物质的量之比,故2molO2和与3molO3的体积之比为2mol:3mol=2:3,
故答案为:相等;2:3;1:1;2:3;
(2)由生成硫酸钡沉淀的质量比为1:2:3,即生成硫酸钡的物质的量之比为1:2:3,
设生成硫酸钡的物质的量分别为n、2n、3n,
则Al2(SO4)3~3BaSO4↓
1 3
n
ZnSO4~BaSO4↓
1 1
2n 2n
Na2SO4~BaSO4↓
1 1
3n 3n
又硫酸铝、硫酸锌、硫酸钠溶液的体积相同,
则浓度之比等于物质的量之比,即为
:2n:3n=1:6:9,
故答案为:1:6:9;
(3)C=
=
=2mol/L,
故答案为:2mol/L;
(4)该饱和溶液中溶质的质量分数为:ω=
,
该溶液的物质的量浓度为:c=
=
mol/L=
mol/L,
故答案为:
mol/L.
| 1000×1.043×7% |
| 36.5 |
故答案为:相等;2:3;1:1;2:3;
(2)由生成硫酸钡沉淀的质量比为1:2:3,即生成硫酸钡的物质的量之比为1:2:3,
设生成硫酸钡的物质的量分别为n、2n、3n,
则Al2(SO4)3~3BaSO4↓
1 3
| n |
| 3 |
ZnSO4~BaSO4↓
1 1
2n 2n
Na2SO4~BaSO4↓
1 1
3n 3n
又硫酸铝、硫酸锌、硫酸钠溶液的体积相同,
则浓度之比等于物质的量之比,即为
| n |
| 3 |
故答案为:1:6:9;
(3)C=
| 1000ρw |
| M |
| 1000×1.043×7% |
| 36.5 |
故答案为:2mol/L;
(4)该饱和溶液中溶质的质量分数为:ω=
| S |
| 100+S |
该溶液的物质的量浓度为:c=
| 1000ρw |
| M |
1000d
| ||
| M |
| 1000Sd |
| M(100+S) |
故答案为:
| 1000Sd |
| M(100+S) |
点评:本题考查物质的量浓度的计算,物质的量浓度和质量分数之间的换算、明确反应中物质之间的关系是解答本题的关键,并熟悉同种物质的质量比等于物质的量之比、同体积的不同溶液的浓度之比等于物质的量之比来解答.

练习册系列答案
相关题目
基态铬原子的电子排布式是( )
| A、1S22S22p63S23p64S14p5 |
| B、1S22S22p63S23p63d6 |
| C、1S22S22p63S23p64S23d4 |
| D、1S22S22p63S23P63d54S1 |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、1L0.1mol?L-1氨水含有0.1lNA个OH- |
| D、1mol甲醇中含有C-H键的数目为3NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、64gSO2中含有的氧原子数为2NA |
| B、同温同压下,相同体积的任何气体所含原子个数相同 |
| C、40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2LH2O含有的电子数为5NA |
下列电子排布图中,属于基态碳的是( )
A、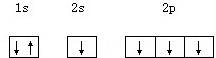 |
B、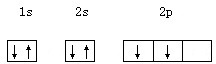 |
C、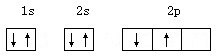 |
D、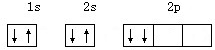 |
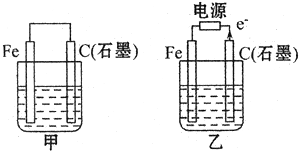 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液.