题目内容
8.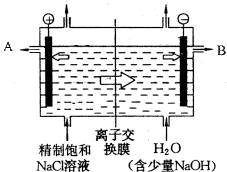 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:请回答下列问题:
(1)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的④⑤通过(填写下列微粒的编号).
①H2,②Cl2,③Cl-,④H+,⑤Na+,⑥OH-.
(2)B极为电解槽的阴极,电极反应式为2H++2e-═H2↑.
(3)若用碱性氢氧燃料电池给予上述电解槽供电,燃料电池的正极反应式为:O2+4e-+2H2O═4OH-; 如果每小时能产生标准状况下的氯气V L,则每小时至少向燃料电池中输入氧气的物质的量(理论计算)$\frac{V}{44.8}$ mol.
(4)若将标准状况下13.44L的阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,得到了两种含氯化合物,其中还原产物与氧化产物物质的量之比为5:1,写出该反应的离子方程式3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.
分析 (1)阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(2)电解时,阳离子向阴极移动,由离子的定向移动可判断电极;
(3)燃料电池中氧气得到电子在碱性溶液中生成氢氧根离子,依据电子守恒和电极反应计算2Cl--2e-═Cl2↑,O2+4e-+2 H2O═4 OH-,电子守恒得到O2~2Cl2;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
解答 解:(1)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,
故答案为:④⑤;
(2)电解池中和电源的正极相连的是电解池的阳极,所以A极为电解槽的阳极,氯离子发生失电子的氧化反应,即2Cl--2e-═Cl2↑,B为电解池的阴极,电极反应为:2 H++2e-═H2↑,
故答案为:阴;2 H++2e-═H2↑;
(3)燃料电池中氧气得到电子在碱性溶液中生成氢氧根离子,电极反应为:O2+4e-+2 H2O═4 OH-,如果每小时能产生标准状况下的氯气V L,依据电子守恒和电极反应计算2Cl--2e-═Cl2↑,O2+4e-+2 H2O═4 OH-,电子守恒得到O2~2Cl2,则每小时至少向燃料电池中输入氧气的物质的量=$\frac{V}{44.8}$mol,
故答案为:O2+4e-+2 H2O═4 OH-;$\frac{V}{44.8}$;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,反应中Cl元素的化合价由0价升高到+5价,还原产物与氧化产物物质的量之比为5:1,所以方程式为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O,
故答案为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子交换膜的作用及阴阳极上发生的反应是解本题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 碳素钢、不锈钢、硬铝、黄铜都属于合金 | |
| B. | 正常雨水的pH为5.6,主要是因为溶解了SO2 | |
| C. | 钢化玻璃常用于制造眼镜片、照相机中的透镜等 | |
| D. | 光化学烟雾主要是由于向大气中任意排放CO2、氟氯烃、SO2等产生的 |
| A. | 36 | B. | 30 | C. | 66 | D. | 60 |
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=(+283.0kJ/mol)×2 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
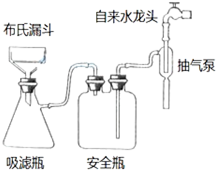 某学生预测定味精(味精的主要成分化学式为C5H8NO4Na•H2O)中食盐的含量,做了如下实验:
某学生预测定味精(味精的主要成分化学式为C5H8NO4Na•H2O)中食盐的含量,做了如下实验: .
. .
.