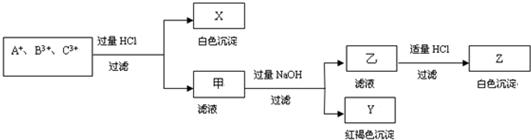
题目内容
17.下列关于热化学反应的描述中正确的是( )| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=(+283.0kJ/mol)×2 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
分析 A.中和热与生成水的物质的量多少没有关系;
B.反应热与物质的量成正比;
C.反应热与反应条件没有必然关系;
D.水的稳定状态为液态,应该生成液态水.
解答 解:A.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量;中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,故A错误;
B.燃烧热是指在101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,CO的燃烧热是283.0kJ/mol,说明1molCO燃烧时放出283.0kJ的能量,在反应方程式2CO2(g)═2CO(g)+O2(g)中,CO的计量数变成2,所以反应热是其燃烧热的2倍,且是吸收能量,故B正确;
C.吸热反应是指生成物成键释放的总能量小于反应物断键吸收的总能量,与是否加热无关,故C错误;
D.根据燃烧热的定义,生成的水必须是液态水,故D错误;
故选B.
点评 本题考查热化学方程式,题目难度不大,明确燃烧热、中和热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
9. 将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )
 将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )| A. | 当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7 | |
| B. | 当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 | |
| C. | NaOH溶液的物质的量浓度为5 mol•L-1 | |
| D. | 生成的H2在标准状况下的体积为11.2L |
5.19世纪中叶,俄国化学家门捷列夫的突出贡献是( )
| A. | 得出完整的元素周期表 | B. | 发现了元素周期律 | ||
| C. | 发现空气的组成 | D. | 提出原子、分子学说 |
9.碘在人体中含量极少,却对人体机能的正常运行起着十分重要的作用.儿童缺碘会导致( )
| A. | 多动症 | B. | 发育迟缓 | C. | 焦虑失眠 | D. | 甲状腺肿大 |
6.下列反应既属于化合反应,又属于氧化还原反应的是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4═FeSO4+H2↑ | D. | MgCO3+2HCl═2MgCl2+CO2↑+H2O |
7.下列物质的性质与氢键无关的是( )
| A. | NH3分子比PH3分子稳定 | |
| B. | 通常情况NH3极易溶于水 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
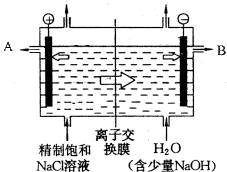 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图: