题目内容
20.下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
| KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的关系有:c(Na+)>c(CO32- )>c(CH3COO- ) | |
| B. | 向0.1 mol•L-1 CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时 c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氢钠固体加入到新制的氯水中,c(HC1O)增大 | |
| D. | 向浓度均为1×10-3 mol•L-1的KC1和K2CrO4混合液中滴加1×10-3 mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
分析 A.CH3COOH的Ka大于H2CO3的Ka2,可知同浓度时碳酸根离子水解程度大;
B.c(CH3COOH):c(CH3COO-)=c(H+):Ka;
C.少量碳酸氢钠固体加入到新制的氯水中,结合Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3)可知,氯气与水的反应正向移动;
D.由c(Ag+)=$\sqrt{Ksp(AgCl)}$、c(Ag+)=$\root{3}{4×Ksp(A{g}_{2}Cr{O}_{4})}$可知,AgCl的溶解度小.
解答 解:A.CH3COOH的Ka大于H2CO3的Ka2,可知同浓度时碳酸根离子水解程度大,则c(CO32- )<c(CH3COO- ),故A错误;
B.c(CH3COOH):c(CH3COO-)=c(H+):Ka=10-5:1.8×10 -5=5:9,故B错误;
C.少量碳酸氢钠固体加入到新制的氯水中,结合Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3)可知,碳酸氢根离子与氢离子反应,氯气与水的反应正向移动,c(HC1O)增大,故C正确;
D.由c(Ag+)=$\sqrt{Ksp(AgCl)}$=1.34×10 -5、c(Ag+)=$\root{3}{4×Ksp(A{g}_{2}Cr{O}_{4})}$=2.0×10-4,可知,AgCl的溶解度小,则Cl-先形成沉淀,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握离子浓度、Ksp的关系、盐类水解、平衡移动为解答的关键,侧重分析与计算能力的考查,注意表格中数据的应用,题目难度不大.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
13.在一定条件,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体的$\frac{1}{8}$,原混合气体中NO2和O2的体积比是( )
①8:1 ②7:3 ③7:1 ④4:1.
①8:1 ②7:3 ③7:1 ④4:1.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
15.氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一.
(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=-905.0KJ•mol-1.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
K1> K2(填“>”或“<”),其判断理由是该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小.
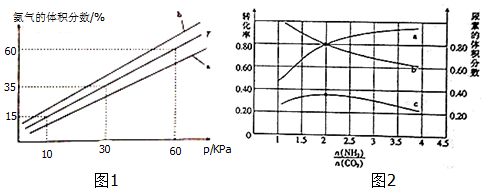
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是 (填字母).AB
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为77.8%.
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响.T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和比为3mol的NH3和CO2以不容的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数.[n(NH3)/n(CO2)]=2时,尿素产量最大;该条件下反应的平衡常数K=40.

(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=-905.0KJ•mol-1.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是 (填字母).AB
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为77.8%.
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响.T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和比为3mol的NH3和CO2以不容的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数.[n(NH3)/n(CO2)]=2时,尿素产量最大;该条件下反应的平衡常数K=40.
5.下图是某些难溶或微溶物在常温下的饱和溶液中的离子浓度关系,其中pM表示阳离子的物质的量浓度的负对数,而pR表示阴离子物质担的负对数,据此分析下列说法中正确的是( )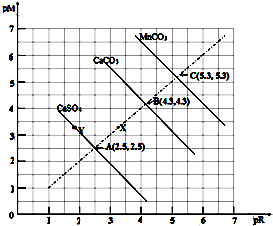

| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
12.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{-5}}{\frac{0.1}{2.2}×1.01×1{0}^{-5}×(\frac{0.3}{2.2}×1.01×1{0}^{-5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)如表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
①X、Y、C三种气体发生反应的化学方程式为Y+3X?2C.
②表中a的取值范围是25.1<a<64.2.
③根据如图3和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强;50min~65min内曲线发生变化的原因可能是增加C的物质的量或增大C的浓度.
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{-5}}{\frac{0.1}{2.2}×1.01×1{0}^{-5}×(\frac{0.3}{2.2}×1.01×1{0}^{-5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)如表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
| 压强/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据如图3和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强;50min~65min内曲线发生变化的原因可能是增加C的物质的量或增大C的浓度.
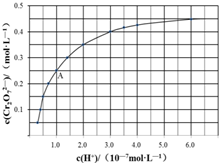 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: