题目内容
7.炼铝厂的废料中主要含Al、Al2O3及少量SiO2和FeO•xFe2O3,可用于制备明矾[KAl(SO4)2•12H2O].工艺流程如下: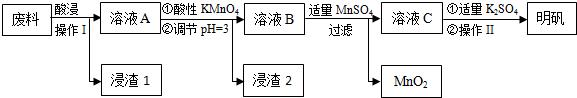
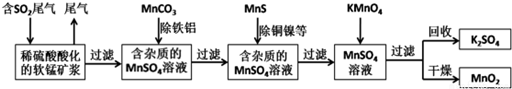
(1)“酸浸”过程中的应选择H2SO4(写酸的化学式).为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有提高反应温度、粉碎等.(写出两条)
(2)操作Ⅰ是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)在溶液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 .
.(4)只用一种试剂检验溶液A中是否存在Fe2+,该试剂是高锰酸钾酸性溶液或铁氰化钾溶液(写名称).
(5)己知在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+.
分析 炼铝厂的废料中主要含Al、Al2O3及少量SiO2和FeO•xFe2O3,为了获得胆矾,所以要用稀硫酸溶解,加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,溶液A中加入酸性高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH=3使铁离子全部沉淀,铝离子不沉淀,所以滤渣2为氢氧化铁,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铝钾晶体,据此答题.
解答 解:炼铝厂的废料中主要含Al、Al2O3及少量SiO2和FeO•xFe2O3,为了获得胆矾,所以要用稀硫酸溶解,加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,溶液A中加入酸性高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH=3使铁离子全部沉淀,铝离子不沉淀,所以滤渣2为氢氧化铁,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铝钾晶体,
(1)根据上面的分析可知,“酸浸”过程中的应选择H2SO4,为提高浸出速率,除适当增大酸的浓度外,还可采取的措施有 提高反应温度、粉碎等,
故答案为:H2SO4;提高反应温度、粉碎等;
(2)根据上面的分析可知,操作Ⅰ是 过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:过滤;蒸发浓缩、冷却结晶;
(3)溶液A中加入酸性高锰酸钾溶液氧化亚铁离子为铁离子,反应的离子方程式为5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,调节pH=3的目的是使Fe3+转化成Fe(OH)3沉淀,防止Al3+沉淀,H2O2的电子式为 ,
,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;使Fe3+转化成Fe(OH)3沉淀,防止Al3+沉淀; ;
;
(4)检验溶液A中是否存在Fe2+的试剂是高锰酸钾酸性溶液或铁氰化钾溶液,
故答案为:高锰酸钾酸性溶液或铁氰化钾溶液;
(5)在pH=3、加热条件下,加入MnSO4发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2+4H+,
故答案为:3Mn2++2MnO4-+2H2O═5MnO2+4H+.
点评 本题考查了流程分析,反应过程理解应用,反应现象和产物的判断,注意离子检验方法,离子方程式书写式关键,题目难度中等.

| A. | 氢氧化钠 | B. | 硫酸 | C. | 氧化铜 | D. | 氨水 |
| 化学键 | H-H | C-H | C≡C |
| 键能/kJ•mol-1 | a | b | c |
| A. | (b-c-a)kJ•mol-1 | B. | (c+3a-4b)kJ•mol-1 | C. | (6b-c-3a)kJ•mol-1 | D. | (c+3a-6b)kJ•mol-1 |
| A. | 化合物:干冰,冰水混合物,烧碱 | B. | 同素异形体:活性炭,C60,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:漂白粉,纯净矿泉水,盐酸 |
| A. | NaCl Na2SO4 | B. | NaCl NaBr Na2SO4 | ||
| C. | NaCl Na2SO4 I2 | D. | NaCl NaI Na2SO4 |
| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 足量二氧化碳通入NaOH溶液:CO2+OH-═HCO3- | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |
实验一:称取3.9200g摩尔盐样品配制250mL溶液.
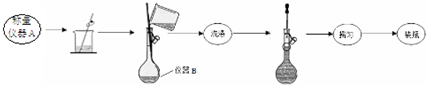
实验二:测定摩尔盐样品组成的方案如下:
①取少量配制液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
②另取少量配制液,加入KSCN溶液,无明显现象.
③定量测定实验如下:
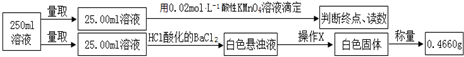
滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)实验一中仪器名称:仪器A电子天平、仪器B250mL容量瓶.
(2)写出实验一中摇匀的实验操作把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀.
(3)实验二③中操作X为过滤、洗涤、干燥或烘干(冷却)((按操作顺序填写).
(4)实验二③中滴定时发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,滴定终点的现象是最后一滴溶液滴入,溶液出现浅紫红色,30秒不褪色.
(5)通过上述实验能否确定摩尔盐样品的组成能(填“能”、“不能”),若能
请写出化学式,若不能请说明理由(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.