题目内容
5.现有CuO、FeO、Fe2O3混合物mg,向其中加入1000mL 0.1mol•L-1硫酸,恰好完全溶解,若mg该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为( )| A. | 无法计算 | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
分析 金属氧化物与硫酸反应生成硫酸盐和水,由反应CuO~CuSO4,Fe2O3~Fe2(SO4)3,FeO~FeSO4,可知H2SO4的物质的量等于金属氧化物中O元素的物质的量,据此计算金属氧化物中氧元素的质量,金属氧化物的质量减去氧的质量即为金属的质量.
解答 解:由反应CuO~CuSO4,Fe2O3~Fe2(SO4)3,FeO~FeSO4,可知H2SO4的物质的量等于金属氧化物中O元素的物质的量,
n(H2SO4)=1L×0.1mol/L=0.1mol,
所以金属氧化物中O的质量为0.1mol×16g/mol=1.6g,
若将mg原混合物在足量氢气中加热,使其充分反应,冷却后剩余固体为金属单质,
则金属质量为氧化物的质量减去氧的质量为(m-1.6)g,
故选D.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、原子守恒为解答的关键,侧重分析与计算能力的考查,注意H与O原子的关系,题目难度不大.

练习册系列答案
相关题目
8.氢镍电池是近年来开发出来的可充电电池,它可以取代会产生污染的镍电池.氢镍电池的总反应式是$\frac{1}{2}$H2+NiO(OH)$?_{充电}^{放电}$ Ni(OH)2,根据此反应式判断,下列叙述中正确的是( )
| A. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,H2是负极 |
9.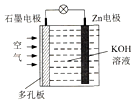 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )| A. | Zn电极是该电池的正极 | |
| B. | Zn电极的电极反应:Zn+H2O-2e-═ZnO+2H+ | |
| C. | OH-向石墨电极移动 | |
| D. | 氧气在石墨电极上发生还原反应 |
20.下列反应能产生Cl2的是( )
| A. | 加热稀盐酸和MnO2的混合物 | |
| B. | 在KMnO4中加入NaCl和浓H2SO4并加热 | |
| C. | KCl加硫酸并加KClO2再加热 | |
| D. | 浓盐酸中加入浓H2SO4并加热 |
10.2016年末,我们大部分地区爆发严重雾霾,雾霾主要由二氧化硫,氮氧化物和可吸入颗粒物和有机碳氢化合物等离子组成,它们与雾气结合在一起,让天空变得阴沉灰暗,下列说法不正确的是( )
| A. | “雾”是微小水滴或冰晶组成的气溶胶系统 | |
| B. | “霾”中的灰尘对大气中的有害物质起吸附作用 | |
| C. | 雾霾中的二氧化硫、氮氧化物主要来自于化石燃料的燃烧 | |
| D. | 雾霾中的有机碳氢化合物主要来自于生物质的燃烧 |
17.下列离子组不能在溶液中大量共存并会同时产生沉淀和气体的是( )
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
14.请选择适当的试剂,用以除去括号内的杂质,并写出相关的化学方程式
A 氯水 B、Fe C、CO2 D、稀盐酸 E、NaOH溶液 F、氨水
A 氯水 B、Fe C、CO2 D、稀盐酸 E、NaOH溶液 F、氨水
| 物 质 | 加入试剂 | 有关化学方程式 |
| NaHCO3 (Na2CO3)(溶液) | ||
| MgO(Al2O3) |
