题目内容
9.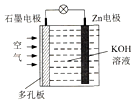 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )| A. | Zn电极是该电池的正极 | |
| B. | Zn电极的电极反应:Zn+H2O-2e-═ZnO+2H+ | |
| C. | OH-向石墨电极移动 | |
| D. | 氧气在石墨电极上发生还原反应 |
分析 根据电池反应式知,锌作负极,负极上电极反应式为:Zn+40H--2e-═ZnO22-+2H20,正极上通入空气,其电极反应式为O2+2H2O+4e-=4OH-,再结合离子移动方向分析解答.
解答 解:A.氧气得电子发生还原反应,是正极,锌是负极,故A错误;
B.锌作负极,碱性条件下,负极上电极反应式为:Zn+4OH--2e-═ZnO22-+2H2O,故B错误;
C.原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn极移动,故C错误;
D.氧气在正极,所以氧气在石墨电极上发生还原反应,故D正确;
故选D.
点评 本题考查了原电池原理,会根据电池反应式中元素化合价变化来确定正负极上发生的电极反应,注意电极反应式的书写与电解质溶液的酸碱性有关,难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
20.如图所示,下列说法不正确的是( )
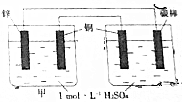

| A. | 乙池中铜电极反应是4OH--4e-═O2↑+2H2O | |
| B. | 甲池中的铜电极反应是2H++2e-═H2↑ | |
| C. | 碳棒上开始H+放电,然后是Cu2+放电 | |
| D. | 反应一段时间后甲乙两池溶液中H+的离子浓度不相同 |
17.C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
4.一定温度下,在2L的密闭容器中发生反应:xA(g)+B(g)?2C(g)△H<0,A、C的物质的量随时间变化的关系如表所示.下列有关说法正确的是( )
| 时间/min | n(A)mol | n(C)mol |
| 0 | 0.3 | 0 |
| 1 | 0.15 | 0.15 |
| 2 | 0.1 | 0.2 |
| 3 | 0.1 | 0.2 |
| A. | x=1 | |
| B. | 反应开始2min内,用B表示的反应速率为0.05mol•L-l•min -1 | |
| C. | 反应进行到lmin时,反应体系达到化学平衡状态 | |
| D. | A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态 |
1.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为285.8 kJ•mol-1 | |
| B. | 同质量的H2 (g)和CH3OH(l)完全燃烧,CH3OH(l)放出的热量多 | |
| C. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ•mol-1 |
8.下列反应的离子方程式书写正确的是( )
| A. | 向碳酸氢钠溶液中滴加氢氧化钠溶液:OH-+HCO3-═CO32-+H2O | |
| B. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl- | |
| C. | 工业上将硫酸工业尾气SO2持续通入氨水中SO2+OH-═HSO3- | |
| D. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
5.现有CuO、FeO、Fe2O3混合物mg,向其中加入1000mL 0.1mol•L-1硫酸,恰好完全溶解,若mg该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为( )
| A. | 无法计算 | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48LCH3C1中所含原子数为NA | |
| C. | 1LpH=1的H2SO4溶液中含有的H+数为0.2NA | |
| D. | 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |