题目内容
15.下列溶液中所含微粒种类最多的是( )| A. | Na2HPO4溶液 | B. | NH4Cl溶液 | C. | CH3COONa溶液 | D. | NaHCO3溶液 |
分析 这几种盐在水溶液里完全电离,弱离子在水溶液里水解,多元弱酸根离子分步水解,以此解答该题.
解答 解:A.Na2HPO4溶液中,HPO42-存在电离和水解,所含粒子为Na+、PO43-、HPO42-、H2PO4-、H3PO4、H2O、H+、OH-,共8种粒子;
B.NH4Cl水溶液中含有H+、OH-、NH3•H2O、NH4+、H2O、Cl-故6种粒子;
C.CH3COONa溶液中,CH3COO-要水解,所含粒子为CH3COO-、Na+、H2O、H+、OH-、CH3COOH,共6种粒子;
D.NaHCO3溶液,HCO3-存在水解和电离,所含粒子为Na+、HCO3-、CO32-、H2CO3、H2O、H+、OH-,共7种粒子,
故选A.
点评 本题考查了盐类水解,根据盐类水解特点结合溶液中存在的微粒种类分析解答,知道多元弱酸根离子要分步水解,知道多元弱酸和多元弱碱水解的区别,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
5.将AgCl 和AgI 的饱和溶液相混合,在其中加入足量AgNO3 固体,将会( )
| A. | 只有AgCl 沉淀 | B. | 只有AgI 沉淀 | ||
| C. | AgCl、AgI 都沉淀,以AgCl 为主 | D. | AgCl、AgI 都沉淀,以AgI 为主 |
6.下列有关实验操作或实验数据的说法正确的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL氢氧化钾溶液 |
3.下列实验事实能用同一原理解释的是( )
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |
10.实验桌上的8杯等物质的量浓度、等体积的溶液,若两两相互混合,则哪一組溶液所含的离子数量最多( )
| A. | NaOH+CH3COOH | B. | BaCl2+CuSO4 | C. | AgNO3+NaCl | D. | Na2SO4+NaOH |
20.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | 大量氢离子的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
7.下列反应的离子方程式书写正确的是( )
| A. | 用稀硫酸清洗铁锈(Fe2O3):Fe2O3+6H+═2Fe3++3H2O | |
| B. | 铝片与硝酸汞溶液反应:Al+Hg2+═Al3++Hg | |
| C. | 硫酸铜溶液和氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ |
4.下列富含糖类的是( )


| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
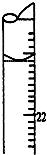 学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为:
学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为: