题目内容
17.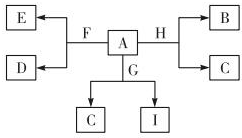 如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.
如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.(1)A与H反应的化学方程式为4H2O+3Fe=$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(2)若D与C反应可得到A,则F的化学式可能为Na2O2.
(3)以Pt为电极,由I、D以及NaOH溶液组成原电池,则D应通入到正(填“正”或“负”)极,另一电极上的电极反应式为CO-2e-+4OH-=CO32-+2H2O.
分析 A是一种常见的液态化合物,可推知A为H2O,G、H形成的合金是当前使用量最大的一种合金,应为碳和铁的合金,B是黑色固体,C、D、G、H均为单质,A与H反应生成B和C,应为铁与水蒸气的反应,所以H为Fe,B为Fe3O4,C为H2,A与G反应为碳与水反应生成一氧化碳和氢气,所以G为C,I为CO,若D与C反应可得到A,则D为O2,所以F可能为Na2O2等,CO与氧气在氢氧化钠溶液中组成原电池时,CO是还原剂,在负极发生氧化反应,氧气是氧化剂在正极反应,据此答题.
解答 解:A是一种常见的液态化合物,可推知A为H2O,G、H形成的合金是当前使用量最大的一种合金,应为碳和铁的合金,B是黑色固体,C、D、G、H均为单质,A与H反应生成B和C,应为铁与水蒸气的反应,所以H为Fe,B为Fe3O4,C为H2,A与G反应为碳与水反应生成一氧化碳和氢气,所以G为C,I为CO,若D与C反应可得到A,则D为O2,所以F可能为Na2O2等,CO与氧气在氢氧化钠溶液中组成原电池时,CO是还原剂,在负极发生氧化反应,氧气是氧化剂在正极反应,
(1)A与H反应为铁与水蒸气在高温条件下生成氢气和四氧化三铁,反应的化学方程式为 4H2O+3Fe=$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,
故答案为:4H2O+3Fe$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;
(2)根据上面的分析可知,F的化学式可能为 Na2O2,
故答案为:Na2O2;
(3)以Pt为电极,由CO、O2以及NaOH溶液组成原电池,CO是还原剂,在负极发生氧化反应,负极的电极反应式为CO-2e-+4OH-=CO32-+2H2O,氧气是氧化剂在正极反应,
故答案为:正;CO-2e-+4OH-=CO32-+2H2O.
点评 本题考查无机物推断,涉及Na、F、C、Fe元素单质化合物性质以及常用化学用语、氧化还原反应计算、原电池等,题目难度中等,答题时注意基础知识的灵活运用.

| A. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NO3-、CO32-、Cl-一定能够大量共存 | |
| C. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 1 L0.1 mol•L-1FeCl3溶液和足量的Zn充分反应,生成11.2 g Fe |
| A. | 测定它的碳、氢元素的质量比 | |
| B. | 只要证明它完全燃烧后产物有H2O和CO2 | |
| C. | 测定其产物中H2O和CO2的比值 | |
| D. | 测定该试样质量及试样完全燃烧后产物的质量 |
| A. | 1 mol NH4+含有的电子数为11NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键 |
| A. | 铜片插A硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 盐酸滴入澄清石灰水:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 将金属Na加入冷水中:2Na+2H2O═2Na+++2OH-+H2↑ | |
| D. | 向含0.5molFeBr2的溶液中通入0.5molC12:2Fe2++C12═2Fe3++2C1- |
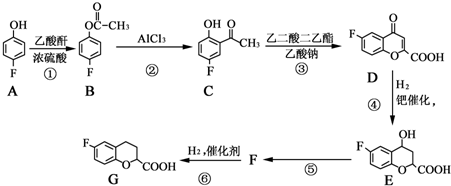
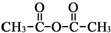
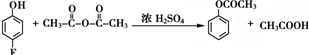 .
.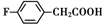 、
、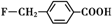
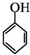 和乙酸酐为原料制备
和乙酸酐为原料制备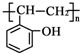 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.