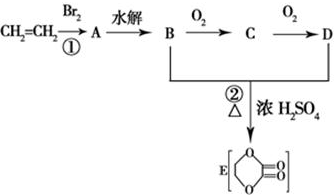
题目内容
9.验证某有机物是由C、H、O三种元素组成的烃的衍生物,应完成的实验内容是( )| A. | 测定它的碳、氢元素的质量比 | |
| B. | 只要证明它完全燃烧后产物有H2O和CO2 | |
| C. | 测定其产物中H2O和CO2的比值 | |
| D. | 测定该试样质量及试样完全燃烧后产物的质量 |
分析 A.无论有机物是否含有O元素,烃的含氧衍生物或烃燃烧都生成H2O和CO2;
B.测定其燃烧产物中H2O和CO2物质的量的比值只能确定C、H元素的比值,不能确定是否含有O;
C.测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比,只能确定C、H元素的比值,不能确定是否含有O;
D.从质量守恒的角度分析.
解答 解:A.烃的含氧衍生物或烃燃烧都生成H2O和CO2,不能确定是否含有O,故A错误;
B.测定其燃烧产物中H2O和CO2物质的量的比值只能确定C、H元素的比值,不能确定是否含有O,故B错误;
C.测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比,只能确定C、H元素的比值,不能确定是否含有O,故C错误;
D.测定该试样的质量及其试样完全燃烧后生成CO2和H2O的质量,可以确定一定质量的有机物中含有C、H元素的质量,根据质量守恒可确定是否含有O元素,故D正确.
故选D.
点评 本题考查有机物分子的元素组成,题目难度不大,注意从质量守恒的角度分析,把握测定原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
4.相等物质的量的金属Mg和Al分别跟足量盐酸反应,所产生的氢气其体积(同温同压)之比为( )
| A. | 1:2 | B. | 2:3 | C. | 8:9 | D. | 1:1 |
14.将铁片投入下列溶液中,溶液质量变大的是( )
| A. | 硝酸银 | B. | 硫酸铁 | C. | 硫酸铜 | D. | 氯化镁 |
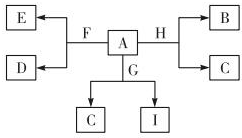 如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.
如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.