题目内容
7.下列叙述中,正确的是( )| A. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NO3-、CO32-、Cl-一定能够大量共存 | |
| C. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 1 L0.1 mol•L-1FeCl3溶液和足量的Zn充分反应,生成11.2 g Fe |
分析 A.氨水为弱碱,二者反应生成氢氧化铝沉淀;
B.加入铝能够生成氢气的溶液为酸性或强碱性溶液,碳酸根离子与氢离子反应;
C.溶液为酸性,则硝酸过量,反应生成铁离子;
D.1 L0.1 mol•L-1FeCl3溶液中含有0.1mol氯化铁,完全反应能够置换出0.1mol铁,质量为5.6g.
解答 解:A.氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀和氯化铵,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A正确;
B.该溶液中存在大量氢离子或氢氧根离子,CO32-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.铁和稀HNO3反应后,溶液pH=2,则硝酸过量,铁被氧化成铁离子,正确的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,故C错误;
D.1 L0.1 mol•L-1FeCl3溶液中含有溶质氯化铁的物质的量为:0.1mol/L×1L=0.1mol,根据质量守恒,0.1mol氯化铁完全反应能够生成0.1molFe,生成铁的质量为:56g/mol×0.1mol=5.6g,故D错误;
故选A.
点评 本题考查较为综合,涉及离子方程式书写、氧化还原反应的计算、离子共存的判断等知识,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.下列溶液中,跟150mL0.5mol/LNaCl溶液所含的氯离子物质的量浓度相同的是( )
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
19.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
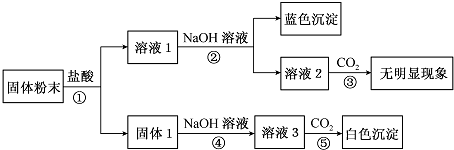
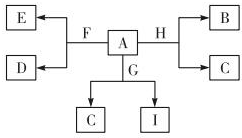 如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.
如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.