题目内容
10. 实验探究气体的体积与物质的量的关系:
实验探究气体的体积与物质的量的关系:(1)如图为电解水的实验装置.图中A试管中收集到的气体是H2,B试管中收集到的气体是O2,二者的体积比是2:1.
(2)物质的量比与气体体积比的关系若有1.8g H2O电解,产生H2质量为0.2g,物质的量为0.1mol;产生O2的质量为1.6g,物质的量为0.05mol;二者物质的量之比为2:1.
分析 (1)分析装置图可知与电源正极相连的电极为电解池阳极,与电源负极相连的电极为电解池阴极,水中氢氧根离子移向阳极失电子生成氧气,氢离子得到电子生成氢气,电池反应为电解水;
(2)气体物质的量之比等于气体体积比,结合化学方程式定量关系计算;
解答 解:(1)分析装置图可知与电源正极相连的电极为电解池阳极,与电源负极相连的电极为电解池阴极,水中氢氧根离子移向阳极失电子生成氧气,氢离子得到电子生成氢气,电池反应为电解水,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,二者的体积比是2:1,
故答案为:H2,O2,2:1;
(2)2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
36 4 32
1.8g 0.2g 1.6g
生成氢气物质的量=$\frac{0.2g}{2g/mol}$=0.1mol,
生成氧气物质的量=$\frac{1.6g}{32g/mol}$=0.05mol,
二者物质的量之比0.1:0.05=2:1
故答案为:0.2,0.1,1.6,0.05,2:1;
点评 本题考查了电解原理的理解应用,电极名称和电极反应分析,化学方程式定量计算是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.一化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol•L-1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
则混合溶液中c(HCO3-)为( )
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
| A. | 1.00mol•L-1 | B. | 0.50mol•L-1 | C. | 1.50mol•L-1 | D. | 2.00mol•L-1 |
19.已知非金属单质在碱性条件下易发生歧化反应,而其生成物在酸性条件下能够发生归中反应,现将aKOH、bH2O、cKCl、dKClO、eCl2、fKClO3可组成一个氧化还原反应,则下列有关说法错误的是( )
| A. | c、d、f之比可能为16:1:3 | |
| B. | 一定有a=2e,b=e | |
| C. | 若n(KClO):n(KClO3)=1:1,则a、b、c、d、e、f依次为8:4:6:1:4:1 | |
| D. | 若将该方程式拆开写成两个“半反应”,其中一定有Cl2-2e-=2Cl- |
1.从海水中提取镁时,涉及不到的化学反应是( )
| A. | MgCl2+Ca(OH)2═CaCl2+Mg(OH)2↓ | B. | Mg(OH)2+2HCl═MgCl2+2H2O | ||
| C. | Mg(OH)2+H2SO4═MgSO4+2H2O | D. | MgCl2$\frac{\underline{\;通电\;}}{熔融}$Mg+Cl2↑ |
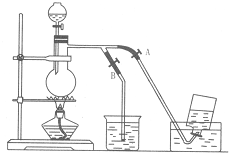 如图表示在没有通风橱收纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.