题目内容
18.一化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol•L-1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
| A. | 1.00mol•L-1 | B. | 0.50mol•L-1 | C. | 1.50mol•L-1 | D. | 2.00mol•L-1 |
分析 第Ⅰ阶段无气体生成说明盐酸滴入溶液中发生的是碳酸根离子和氢离子生成碳酸氢根离子的过程,反应生成的碳酸氢根离子与氯化氢的物质的量相等;第Ⅱ阶段碳酸氢根离子与氢离子反应生成二氧化碳气体,根据消耗的盐酸的物质的量可计算出参加反应的碳酸氢根离子的总物质的量,再根据Ⅰ中生成的碳酸氢根离子可计算出原混合液中碳酸氢根离子的物质的量,最后根据c=$\frac{n}{V}$计算出原混合液中碳酸氢根离子的浓度.
解答 解:第Ⅰ阶段无气体生成说明盐酸滴入溶液中发生的是碳酸根离子和氢离子生成碳酸氢根离子的过程,反应为CO32-+H+=HCO3-,消耗盐酸体积10ml,碳酸钠全部转化为碳酸氢钠,氯化氢物质的量为:0.010ml×1.00mol•L-1=0.01mol,则反应生成碳酸氢根离子的物质的量为0.01mol,
第Ⅱ阶段发生反应:HCO3-+H+=H2O+CO2↑,则参加反应的碳酸氢根离子的总物质的量为:(0.04L-0.01L)×1.00mol/L=0.03mol,
则原溶液中碳酸氢根离子的物质的量为:0.03mol-0.01mol=0.02mol,
所以原混合液中碳酸氢根离子的浓度为:c(HCO3-)=$\frac{0.02mol}{0.02L}$=1mol/L,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确每一阶段发生的反应实质为解答关键,注意掌握碳酸根离子、碳酸氢根离子与酸反应的离子方程式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
9.吸烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb•O2?O2 +Hb•CO,实验表明,Hb•CO的浓度即使只有Hb•O2的2%时候也足以使人的智力受损.某人吸烟后,在肺部的空气中测得的CO和O2的浓度分别为10-6mol/L和10-2mol/L.已知37℃时,平衡常数K=220,下列说法正确的是( )
| A. | 若加大吸入氧气量,逆反应速率加快,正反应速率减慢 | |
| B. | 若加大吸入氧气量,可改变K值 | |
| C. | 该人血液中Hb•CO浓度在正常范围内,故其智力不会受到损害 | |
| D. | 对于煤气中毒者应立即转移至空气流通处 |
3.如图R、W、X、Y、Z为五种物质,若箭头表示能一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
| 选项 | R | W | X | Y | Z |  |
| A | Si | SiO2 | H2SiO3 | Na2SiO3 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
| A. | A | B. | B | C. | C | D. | D |

 实验探究气体的体积与物质的量的关系:
实验探究气体的体积与物质的量的关系: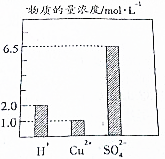 在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题: