题目内容
13.甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.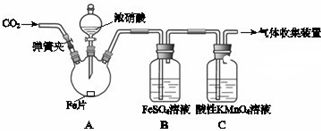
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)证明A溶液中是否含有Fe3+,选择的药品是(填序号)d
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
(4)根据实验现象写出A中一定发生反应的化学方程式Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O.
分析 (1)依据常温下铁在浓硝酸中发生钝化分析,常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生;
(2)若有-3价氮的化合物生成,应生成NH4+,检验A溶液中是否有NH4+离子即可;
(3)检验亚铁离子的试剂为铁氰化钾溶液,证明铁离子的试剂可以用硫氰化钾溶液,亚铁离子和铁鉄氰化钾溶液反应生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液;
(4)A中一定发生铁与热的浓硝酸反应,反应的化学方程式为:Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O,由此分析解答.
解答 解:(1)常温时,铁和浓硝酸反应生成一层致密的氧化物薄膜,阻止了铁和浓硝酸进一步反应,即产生钝化现象,所以滴入浓硝酸加热前没有明显现象,
故答案为:常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生;
(2)生成-3价氮的化合物是氨气,氨气极易溶于水生成氨水,氨水电离生成铵根离子,检验铵根离子的方法是:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+,
故答案为:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+;
(3)亚铁离子的特征反应是:亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,铁离子的特征反应是:铁离子和无色的硫氰化钾溶液反应血红色溶液,证明A溶液中是否含有Fe3+,用无色的硫氰化钾溶液,故答案为:d;
(4)A中一定发生铁与热的浓硝酸反应,反应的化学方程式为:Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O,
故答案为:Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O.
点评 本题考查性质方案的设计,题目难度中等,涉及铁、硝酸的性质,铁离子的检验,为高考热点,注意常温时,铁和浓硝酸不是不反应,而是发生了钝化现象,阻止了进一步反应,为易错点,试题培养了学生的分析能力及化学实验能力.

| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190 | -70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ②③④ |
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
①CaCl2溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液.
| A. | ①②③④ | B. | 只有②④ | C. | 只有①②③ | D. | 只有④ |
| A. | H2SiO3 | B. | H3PO4 | C. | H2SO4 | D. | HClO |
| A. | :He | B. |  | C. | 1s2 | D. |  |
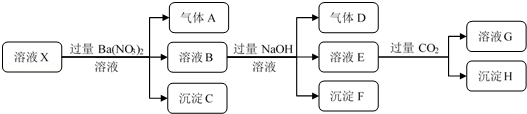
| A. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ | |
| B. | 沉淀H为Al(OH)3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.15 mol•L |
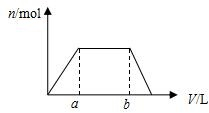 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )| A. | 10(b-a)/22.4 mol/L | B. | 20(b-a)/22.4 mol/L | ||
| C. | 10b/22.4 mol/L | D. | 10a/22.4 mol/L |
| A. | S2-+Cl2═S↓+2Cl- | B. | S2-+2Br-+2Cl2═S↓+Br2+4Cl- | ||
| C. | 2S2-+2Br-+3Cl2═2S↓+Br2+6Cl- | D. | 3S2-+2Br-+4Cl2═3S↓+Br2+8Cl- |