题目内容
3.含等物质的量浓度的Na2S和NaBr的溶液中缓慢通入氯气,下列离子方程式不符合实际情况的是( )| A. | S2-+Cl2═S↓+2Cl- | B. | S2-+2Br-+2Cl2═S↓+Br2+4Cl- | ||
| C. | 2S2-+2Br-+3Cl2═2S↓+Br2+6Cl- | D. | 3S2-+2Br-+4Cl2═3S↓+Br2+8Cl- |
分析 还原性硫离子大于溴离子,通入氯气先发生Na2S+Cl2═2NaCl+S↓、氯气足量再氧化NaBr,结合氧化的先后顺序及电子守恒解答.
解答 解:A.氯气少量时发生S2-+Cl2═S↓+2Cl-,故A正确;
B.S2-+2Br-+2Cl2═S↓+Br2+4Cl-中不符合等物质的量浓度的Na2S和NaBr,故B错误;
C.氯气足量时发生2S2-+2Br-+3Cl2═2S↓+Br2+6Cl-,故C正确;
D.氯气足量时且溴离子部分氧化发生3S2-+2Br-+4Cl2═3S↓+Br2+8Cl-,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握物质的性质、发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化的先后顺序及离子反应中电子、电荷守恒,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
13.甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
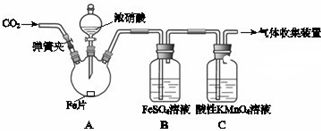
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)证明A溶液中是否含有Fe3+,选择的药品是(填序号)d
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
(4)根据实验现象写出A中一定发生反应的化学方程式Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O.

文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)证明A溶液中是否含有Fe3+,选择的药品是(填序号)d
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
(4)根据实验现象写出A中一定发生反应的化学方程式Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O.
9.西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南子•万毕术》一书中有一段文字记载:“曾青得铁则化铜”.“曾青”(铜的化合物)是指( )
| A. | CuCl2 | B. | CuSO4 | C. | Cu(OH)2 | D. | CuCO3 |
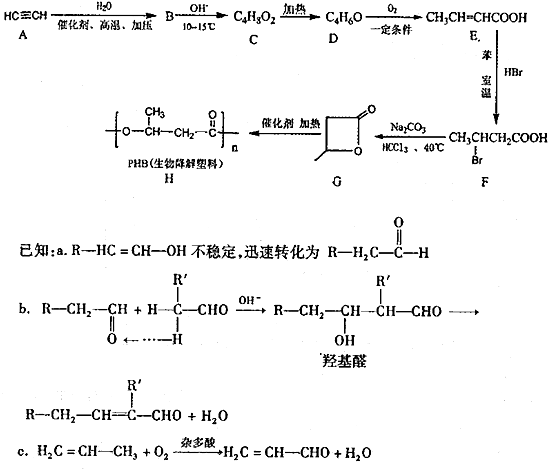
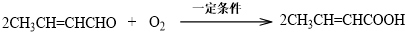 .
.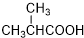 .
.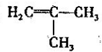 为起始原料(其他原料任选),制备
为起始原料(其他原料任选),制备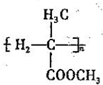 的合成路线:
的合成路线: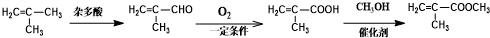
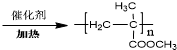 .
.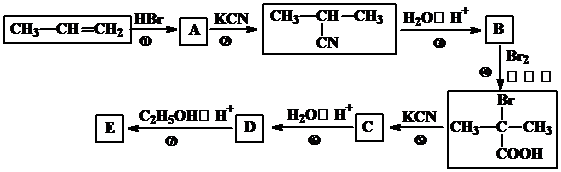
 .
.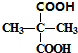 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.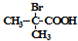 与足量NaOH乙醇溶液反应的化学方程式为
与足量NaOH乙醇溶液反应的化学方程式为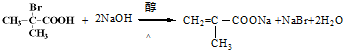 .
. 、
、 .
.