题目内容
1.常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
分析 A.0.1mol•L-1pH为4的NaHA溶液显酸性,HA-离子电离程度大于其水解程度;
B.在饱和氯水中加入NaOH使pH=7,c(H+)=c(0H-),由电荷守恒可知,c(Na+)=c(ClO-)+c(Cl-),反应后溶质为NaCl、NaClO、HClO,由Cl2+H2O?HClO+HCl可知,c(Cl-)=c(ClO-)+c(HClO),据此分析判断;
C.溶液中电荷守恒和物料守恒联立计算分析判断;
D.0.10mol•L-1Na2SO3溶液通入少量SO2,反应生成亚硫酸钠和亚硫酸氢钠,结合物料守恒分析判断.
解答 解:A.0.1mol•L-1pH为4的NaHA溶液显酸性,HA-离子电离程度大于其水解程度,c(HA-)>c(A2-)>c(H2A),故A错误;
B.在饱和氯水中加入NaOH使pH=7,c(H+)=c(0H-),由电荷守恒可知,c(Na+)=c(ClO-)+c(Cl-),反应后溶质为NaCl、NaClO、HClO,由Cl2+H2O?HClO+HCl可知,c(Cl-)=c(ClO-)+c(HClO),则离子浓度大小为c(Na+)>c(Cl-)>c(ClO-)>c(HClO),故B错误;
C.0.10mol•L-1 KHC2O4溶液中电荷守恒:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(H+)+c(K+),物料守恒c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),代入消去钾离子得到,c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-),故C正确;
D.0.10mol•L-1Na2SO3溶液通入少量SO2,反应后生成亚硫酸钠和亚硫酸氢钠,2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3)],故D错误;
故选C.
点评 本题考查了离子浓度大小比较、电荷守恒、物料守恒、盐类水解的原理等知识,题目难度中等.

| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
| A. | HCl | B. | KOH | C. | CaCl2 | D. | NH4 NO3 |
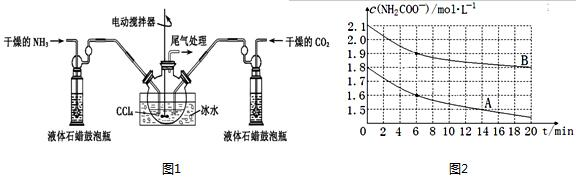
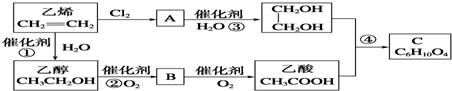
 ;
; .
.