题目内容
12.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、极易水解,可用作肥料、灭火剂、洗涤剂等.实验室用如图1所示装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体最浮在四氯化碳,当悬浮物较多时,停止制备.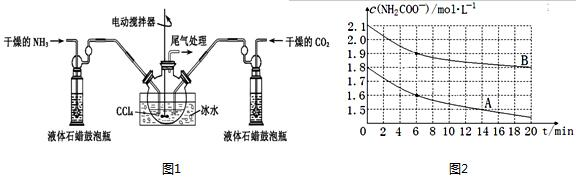
(1)结合上述实验装置,写出制备氨基甲酸铵的化学方程式2NH3(g)+CO2(g)?NH2COONH4.该反应为放热反应(填“吸热”或“放热”)
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,控制气体流速和调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤.
(4)氨基甲酸铵极易水解,产物是碳酸氢铵和一种弱碱,请写出其水解反应方程式NH2COONH4+2H2O?NH4HCO3+NH3•H2O;.某学习小组为探究其水解反应,分别取两份不同浓度的氨基甲酸铵溶液,绘制出c(NH2COO-)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行.
(5)制得的氨基甲酸按可能含有碳酸氢铵.取某氨基甲酸样品4.69g,用足量氢氧化钡溶液充分处理后,使碳元素完全转化为碳酸钡,过滤、洗涤、干燥、测得沉淀质量为11.82g.则样品中氨基甲酸铵的物质的量分数为83.3%.
分析 (1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4;氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应;
(2)根据液体石蜡瓶鼓泡瓶中气泡控制气体流速和原料气体的配比;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O;水解反应为吸热反应,升高温度有利于水解进行,对比6~20min内c(NH2CCOO-)变化量越大,水解程度越大,温度越高;
(5)生成的沉淀为碳酸钡,根据碳原子守恒、混合物总质量列方程各自物质的量,再计算氨基甲酸胺的质量,进而计算其物质的量分数.
解答 解:(1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应,
故答案为:2NH3(g)+CO2(g)?NH2COONH4;放热;
(2)可以根据液体石蜡瓶鼓泡瓶中气泡,控制气体流速和调节NH3与CO2通入比例,
故答案为:通过观察气泡,控制气体流速和调节NH3与CO2通入比例;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离,
故答案为:过滤;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O,反应方程式为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行,故曲线A的温度高于曲线B的,
故答案为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;A;6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行;
(5)生成的沉淀为碳酸钡,其物质的量为:$\frac{11.82g}{197g/mol}$=0.06mol,
氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,
由碳元素守恒可知:x+y=0.06
由质量可得:78x+79y=4.69
解得x=0.05mol,y=0.01mol,
则制得的样品中氨基甲酸胺的物质的量分数为:$\frac{0.05mol}{0.06mol}$×100=83.3%,
故答案为:83.3%.
点评 本题考查物质制备实验、化学反应速率影响因素、物质含量测定、化学与技术等,题目难度中等,把握反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 戊烷 | B. | 乙烷 | C. | 庚烷 | D. | 十二烷 |
 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| A. |  | B. |  | ||
| C. |  | D. | CH2OH(CHOH)4CHO |

 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.