题目内容
10.结合已学知识,并根据下列一组物质的特点回答相关问题.
(1)邻二甲苯的结构简式为E(填编号).
(2)A、B、C之间的关系为B(填序号).
A.同位素B.同系物C.同分异构体D.同素异形体
(3)请设计一个简单实验来检验A与D,简述实验操作过程:取少量A、D分别装入两支试管中,向两支试管中各滴入少量KMnO4酸性溶液,振荡,若溶液褪色,则为D,无现象的为A.
分析 (1)由结构可知,C、D、E为二甲苯,E中两个甲基相邻;
(2)A、B、C均含一个苯环,结构相似,分别相差1个CH2原子团;
(3)苯与高锰酸钾不反应,二甲苯能被高锰酸钾氧化.
解答 解:(1)由结构可知,C、D、E为二甲苯,E中两个甲基相邻,则邻二甲苯的结构简式为E,
故答案为:E;
(2)A、B、C均含一个苯环,结构相似,分别相差1个CH2原子团,则互为同系物,
故答案为:B;
(3)苯与高锰酸钾不反应,甲苯能被高锰酸钾氧化,则鉴别A、B的实验过程为取少量A、D分别装入两支试管中,向两支试管中各滴入少量KMnO4酸性溶液,振荡,若溶液褪色,则为D,无现象的为A,
故答案为:取少量A、D分别装入两支试管中,向两支试管中各滴入少量KMnO4酸性溶液,振荡,若溶液褪色,则为D,无现象的为A.
点评 本题考查有机物的结构与性质,为高频考点,把握苯及同系物的性质等为解答的关键,侧重分析与应用能力的考查,注意有机物的检验与性质应用,题目难度不大.

练习册系列答案
相关题目
20.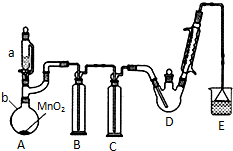 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
(1)仪器b的名称为圆底烧瓶,装置B中的试剂是饱和食盐水,装置A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
1.常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
18.质子数≤18的A和M两种元素,已知A2-与M+的电子数之差为8,则下列说法正确的是( )
| A. | A和M原子的最外层电子数之差不一定为5 | |
| B. | A和M原子的最外层电子数之和一定为7 | |
| C. | A和M原子的电子数之差一定为11 | |
| D. | A和M的原子序数之差不一定为5 |
5.下列叙述中,正确的是( )
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 一种微粒与另一种微粒的质子数和电子数均相等,它们可能是一种离子和一种分子 | |
| D. | 不存在两种质子数和电子数均相同的阳离子和阴离子 |
15.下列说法中错误的是( )
| A. | 需要加热才能发生的反应不一定是吸收热量的反应 | |
| B. | 科学家经常在金属与非金属的交界线处寻找良好的半导体材料 | |
| C. | 催化剂是影响化学反应速率和化学平衡的一个重要因素 | |
| D. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 |
2.下列物质中含有官能团种类最多的是( )
| A. |  | B. |  | ||
| C. |  | D. | CH2OH(CHOH)4CHO |
20.甲烷与氯气发生取代反应,生成的四种不同的氯代物中,分子结构为正四面体型的是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CHCl3 | D. | CCl4 |
 .
.