题目内容
9.甲烷和乙烯的混合气体20mL,完全燃烧需45mL氧气(同温同压下),则此混合气体中甲烷和乙烯的体积比是( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
分析 反应的方程式分别为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O,设出甲烷和乙烯的体积,然后根据方程式及消耗氧气的体积列式计算.
解答 解:设混合气体中甲烷的体积为x,乙烯的体积为y,
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
1 2
x 2x
C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O
1 3
y 3y
$\left\{\begin{array}{l}{x+y=20}\\{2x+3y=45}\end{array}\right.$,解之得$\left\{\begin{array}{l}{x=15}\\{y=5}\end{array}\right.$,整理可得:x:y=3:1,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
11.有机物A的相对分子质量不超过150,经测定A具有下列性质:
(1)填写表中空白.
(2)若A分子中氧元素的质量分数为59.7%,则A的分子式为C4H6O5.
(3)若A分子中无含碳支链,写出反应③的化学方程式: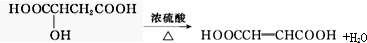 .
.
(4)下列物质与A互为同系物的是b(填字母).
a.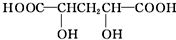
b.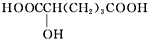
c.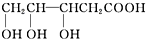
d.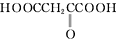
| A的性质 | 推断A的组成、结构 |
| ①能燃烧,燃烧产物只有CO2和H2O | 一定含有C、H元素,可能含有O元素 |
| ②A与醇或羧酸在浓硫酸存在下均能生成有香味的物质 | A分子中含有-OH、-COOH |
| ③在一定条件下,A能发生分子内脱水反应,其生成物与溴水混合,溴水褪色 | - |
| ④0.1mol A与足量NaHCO3溶液反应产生4.48L(标准状况下)气体 | A分子中含有两个-COOH |
(2)若A分子中氧元素的质量分数为59.7%,则A的分子式为C4H6O5.
(3)若A分子中无含碳支链,写出反应③的化学方程式:
 .
.(4)下列物质与A互为同系物的是b(填字母).
a.
b.
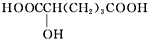
c.

d.
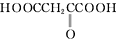
20.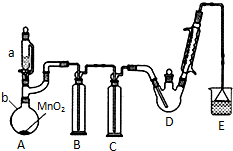 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
(1)仪器b的名称为圆底烧瓶,装置B中的试剂是饱和食盐水,装置A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
1.常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
18.质子数≤18的A和M两种元素,已知A2-与M+的电子数之差为8,则下列说法正确的是( )
| A. | A和M原子的最外层电子数之差不一定为5 | |
| B. | A和M原子的最外层电子数之和一定为7 | |
| C. | A和M原子的电子数之差一定为11 | |
| D. | A和M的原子序数之差不一定为5 |
 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.
 .
.