题目内容
10.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )| A. | SO2直线形 | B. | CO2平面三角形 | C. | BCl3三角锥形 | D. | CH4正四面体形 |
分析 根据价层电子对互斥理论确定微粒的空间构型,价层电子对个数=σ键个数+孤电子对个数,
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:A.SO2分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3且含有1个孤电子对,所以为V形结构,故A错误;
B.CO2分子中价层电子对个数=2+$\frac{1}{2}$×(4-2×2)=2且不含有孤电子对,所以为直线形结构,故B错误;
C.BCl3分子中B原子的价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3且不含有孤电子对,所以其空间构型为三角形,故C错误;
D.CH4中碳原子价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,所以C原子采用sp3杂化,不含有孤电子对,所以其空间构型为正四面体结构,故D正确;
故选D.
点评 本题考查了微粒空间构型的判断,利用价层电子对互斥理论分析解答即可,难点是孤电子对的计算方法,题目难度不大.

练习册系列答案
相关题目
12.下列说法错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg碳-12含有约6.02×1023个碳原子 | |
| C. | 阿伏伽德罗常数的数值约等于6.02×1023 | |
| D. | 使用摩尔时必须指明微粒的名称 |
1.下列说法不正确的是( )
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 利用下面反应H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0,不可以设计成原电池装置 |
5.下列离子方程式正确的是( )
| A. | 铁与稀HNO3反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 向小苏打溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
15.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
| A. | 高铁酸钾中铁显+3价 | |
| B. | 湿法中每生成1mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1mol Na2FeO4转移4 mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质 |
2.油条是我国北方的传统食品,其做法是将明矾,碱,食盐按比例加入温水中,再加入面粉搅拌成面团,放置,使面团产生气体,形成孔洞,达到柔顺,放置过程发生反应:3Na2CO3+2KAl(SO4)2•12H2O═3Na2SO4+K2SO4+3CO2↑+2A1(OH)3↓+21H2O,下列有关判断正确的是( )
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
19.下列实验装置不能达到实验目的是( )
| A. | 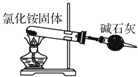 用装置来制备氨气 | |
| B. | 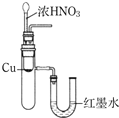 用装置来验证Cu与浓硝酸反应的热量变化 | |
| C. | 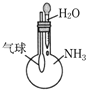 用装置来验证氨气极易溶于水 | |
| D. | 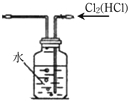 用装置来除去Cl2中混有的HCl气体 |
20. 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
[转化率=(某反应物转化的物质的量/该反应物起始的总的物质的量)×100%]
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,NO的转化率为65%;
(2)图中表示 NO2变化曲线的是b;用 O2表示 0~2s内该反应的平均速率υ=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是BC(填字母序号).
A.υ(NO2)=2υ(O2)B.容器内压强保持不变
C.υ逆(NO)=2υ正(O2)D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,NO的转化率为65%;
(2)图中表示 NO2变化曲线的是b;用 O2表示 0~2s内该反应的平均速率υ=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是BC(填字母序号).
A.υ(NO2)=2υ(O2)B.容器内压强保持不变
C.υ逆(NO)=2υ正(O2)D.容器内密度保持不变.