题目内容
9.NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
分析 A、用过氧化钠制取氧气时,氧元素的价态由-1价变为0价;
B、(NH4)2Fe(SO4)2•6H2O晶体由2个铵根离子、1个亚铁离子和2个硫酸根离子构成;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、HCO3-既能水解又能电离.
解答 解:A、用过氧化钠制取氧气时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故A错误;
B、(NH4)2Fe(SO4)2•6H2O晶体由2个铵根离子、1个亚铁离子和2个硫酸根离子构成,故1mol(NH4)2Fe(SO4)2•6H2O晶体中含5NA个离子,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故2.24L混合气体的物质的量小于0.1mol,则含有的氧原子的个数小于0.2NA个,故C错误;
D、HCO3-既能部分水解为H2CO3又能部分电离为CO32-,故溶液中的H2CO3、HCO3-和CO32-的个数总和为0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列试剂中,能用于鉴别SO2和CO2的是( )
| A. | 澄清石灰水 | B. | 品红溶液 | C. | 紫色石蕊溶液 | D. | 氯化钡溶液 |
12.下列说法错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg碳-12含有约6.02×1023个碳原子 | |
| C. | 阿伏伽德罗常数的数值约等于6.02×1023 | |
| D. | 使用摩尔时必须指明微粒的名称 |
17.对于化学反应3W(g)+2X (g)?4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
| A. | v(W)=v(Z) | B. | 2v(X)=3v(Z) | C. | v(X)=2v(Y) | D. | 3v(W)=2v(X) |
4. 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4熔、沸点依次增高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强.
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是O>Ge>Zn.
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3微粒之间存在的作用力是共价键.
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为($\frac{1}{2}$,0,$\frac{1}{2}$);C为($\frac{1}{2}$,$\frac{1}{2}$,0).则D原子的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$).
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为$\frac{8×73}{6.02×{{565.76}^{3}}}×{{10}^{7}}$g•cm-3(列出计算式即可).
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4熔、沸点依次增高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3微粒之间存在的作用力是共价键.
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为($\frac{1}{2}$,0,$\frac{1}{2}$);C为($\frac{1}{2}$,$\frac{1}{2}$,0).则D原子的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$).
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为$\frac{8×73}{6.02×{{565.76}^{3}}}×{{10}^{7}}$g•cm-3(列出计算式即可).
1.下列说法不正确的是( )
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 利用下面反应H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0,不可以设计成原电池装置 |
19.下列实验装置不能达到实验目的是( )
| A. |  用装置来制备氨气 | |
| B. |  用装置来验证Cu与浓硝酸反应的热量变化 | |
| C. |  用装置来验证氨气极易溶于水 | |
| D. |  用装置来除去Cl2中混有的HCl气体 |
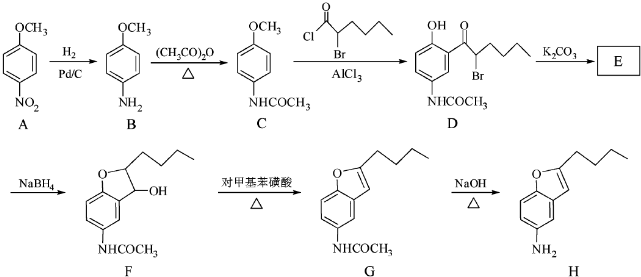
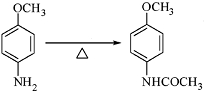 +CH3COOH
+CH3COOH .
.