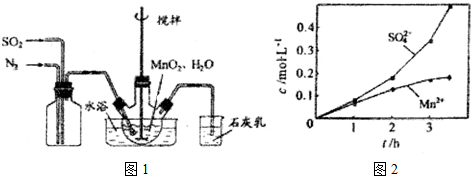
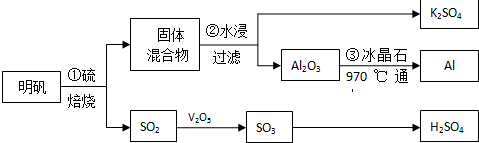
题目内容
13.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3.下列叙述正确的是( )| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) | |
| C. | 浓度均为0.1mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 常温下,0.1mol•Ll-1某一元酸(HA)溶液的pH=3,说明该酸在其水溶液里只有部分电离,则HA是弱酸,
A.根据HA溶液中的质子守恒进行分析;
B.根据混合液中的物料守恒和电荷守恒判断;
C.由于酸的电离程度大于酸根离子的水解程度,则c(Na+)>c(HA);
D.HA为弱酸,混合液中酸过量,溶液显示酸性,则c(H+)>c(OH-).
解答 解:常温下,0.1mol•Ll-1某一元酸(HA)溶液的pH=3,说明该酸在其水溶液里只有部分电离,所以是弱酸,
A.根据质子守恒得c(H+)=c(A-)+c(0H-),两边都同乘以c(H+),所以得c2(H+)=c(H+)•c(A+)+KW,故A错误;
B.混合溶液中存在浓度均为0.025 mol•L-l的HA和NaA溶液,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(A-),根据物料守恒得:2c(Na+)=c(A-)+c(HA),根据质子守恒得c(OH-)=c(H+)+c(HA),所以2c(H+)+c(HA)=c(A-)+2c(OH-),故B正确;
C.浓度均为0.1 mol•L-l的HA和NaA溶液等体积混合,酸的电离程度大于酸根离子的水解程度,所以所得溶液中:c(Na+)>c(HA),故C错误;
D.pH=3的HA溶液与pH=11的NaOH溶液等体积混合,HA为弱酸,则混合液中酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(A-)>c(Na+),所得溶液中正确的离子浓度大小为:c(A-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查酸碱混合溶液中离子浓度大小的比较,题目难度中等,根据电荷守恒、物料守恒及质子守恒来分析解答,试题培养了学生的分析能力及灵活应用能力.

| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液 |
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
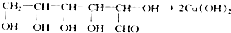 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$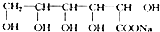 +Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
+Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒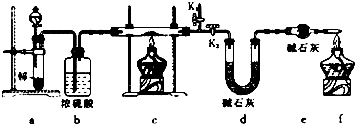
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl; 已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.