题目内容
8. 已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.(1)NaClO溶液中通入少量CO2发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
(2)在饱和氯水中加入NaHCO3,直至溶液的黄绿色褪去,则发生反应的离子方程式为Cl2+H2O?H++Cl-+HClO,H++HCO3-=H2O+CO2↑.
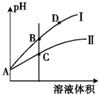
(3)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示.
①曲线Ⅰ为HF稀释时pH的变化曲线.
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗HClO体积较小.
(4)25℃时,将0.40mol•L-1 HCN溶液与0.20mol•L-1 NaOH溶液各100mL混合后,测得溶液的pH=a(a>7).则该溶液中所有离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+);c(HCN)-c(CN-)=2[10 a-14-10-a]mol•L-1.(假设混合后体积等于两种溶液体积之和)
分析 (1)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;
(2)H2CO3的Ka1=4.2×10-7>HClO的Ka=3.0×10-8>H2CO3的Ka2=5.6×10-11,所以氯水中加入NaHCO3,只有盐酸反应,而次氯酸不反应,由此分析解答;
(3)①根据HClO的Ka=3.0×10-8<HF的Ka=3.5×10-4,氢氟有酸是强于次氯酸,相同温度下,相同pH值的氢氟酸和次氯酸溶液,次氯酸浓度大,溶液稀释时,次氯酸进一步电离,其溶液中离子浓度大于氢氟酸的离子浓度;
②中和相同体积、相同浓度的NaOH溶液,酸性弱的消耗的量少;
(4)25℃时,将0.40mol•L-1 HCN溶液与0.20mol•L-1 NaOH溶液各100mL混合后,得到等物质的量浓度的NaCN和HCN的混合溶液,以NaCN的水解占主导,所以离子浓度大小为:c(Na+)>c(CN-)>c(OH-)>c(H+),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CN-)、根据物料守恒得2c(Na+)=c(HCN)+c(CN-),所以得c(HCN)+2c(H+)=2c(OH-)+c(CN-),则c(HCN)-c(CN-)=2c(OH-)-2c(H+).
解答 解:(1)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,
故答案为:ClO-+CO2+H2O═HClO+HCO3-;
(2)H2CO3的Ka1=4.2×10-7>HClO的Ka=3.0×10-8>H2CO3的Ka2=5.6×10-11,所以氯水中加入NaHCO3,只有盐酸反应,而次氯酸不反应,所以发生反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,H++HCO3-=H2O+CO2↑,故答案为:Cl2+H2O?H++Cl-+HClO,H++HCO3-=H2O+CO2↑;
(3)①根据HClO的Ka=3.0×10-8<HF的Ka=3.5×10-4,氢氟有酸是强于次氯酸,相同温度下,相同pH值的氢氟酸和次氯酸溶液,次氯酸浓度大,溶液稀释时,次氯酸进一步电离,其溶液中离子浓度大于氢氟酸的离子浓度,所以pH变化小的曲线为次氯酸,故II应为次氯酸稀释时的pH值变化曲线,则Ⅰ为HF,故答案为:HF;
②中和相同体积、相同浓度的NaOH溶液,酸性弱的消耗的量少,所以HClO消耗体积较小,故答案为:HClO;
(4)25℃时,将0.40mol.L-1HCN溶液与0.20mol.L-1NaOH溶液各100mL混合后,混合溶液中溶质为等物质的量浓度的HCN和NaCN,测得溶液的pH=a(a>7),溶液呈碱性,则c(H+)<c(OH-),说明NaCN水解程度大于HCN,结合电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-)得c(Na+)>c(CN-),盐类水解较微弱,所以离子浓度大小顺序是c(Na+)>c(CN-)>c(OH-)>c(H+);
根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CN-)、根据物料守恒得2c(Na+)=c(HCN)+c(CN-),所以得c(HCN)+2c(H+)=2c(OH-)+c(CN-),则c(HCN)-c(CN-)=2c(OH-)-2c(H+)=2[10 a-14-10-a]mol/L,
故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);2[10 a-14-10-a].
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确各个物理量之间关系是解本题关键,注意电荷守恒、物料守恒的灵活运用,注意该混合溶液中HCN电离程度小于CN-水解程度.

| A. | 7.8 g | B. | 13.6 g | C. | 5.8g | D. | 4g |
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) | |
| C. | 浓度均为0.1mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
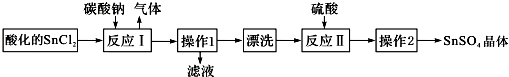
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+═CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次 | |
| D. | 操作1为过滤,操作2为盐析 |
| A. | CH4 | B. | NH3 | C. | BF3 | D. | SO3 |
 ,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.
,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3. .
.