题目内容
5.已知HF的酸性比HCN的酸性强.现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中的离子数目为n1,后者溶液中的离子数目为n2,则下列关系正确的是( )| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
分析 HF的酸性比HCN的酸性强,HF的电离程度大于HCN,则其酸根离子水解程度F-<CN-,相同温度下,物质的量浓度和体积均相同的NaF和NaCN两种溶液中两种盐的物质的量相等,溶液中存在电荷守恒和物料守恒,根据电荷守恒判断.
解答 解:HF的酸性比HCN的酸性强,HF的电离程度大于HCN,则其酸根离子水解程度F-<CN-,相同温度下,物质的量浓度和体积均相同的NaF和NaCN两种溶液中两种盐的物质的量相等,
根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(F-)、c(Na+)+c(H+)=c(OH-)+c(CN-),两种溶液中离子浓度分别是其溶液中所有阳离子浓度的2倍,
因为酸根离子水解程度F-<CN-,则c(F-)>c(CN-),所以NaF溶液中氢离子浓度大于NaCN,两种溶液中钠离子浓度相等,
所以NaF溶液中离子个数大于NaCN离子个数,即n1>n2,
故选B.
点评 本题以离子个数比较为载体考查了盐类水解,题目难度中等,明确电离平衡常数与酸根离子水解程度的关系是解本题关键,然后再采用电荷守恒、离子代换等方法来分析解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3.下列叙述正确的是( )
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) | |
| C. | 浓度均为0.1mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
20.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业.SnSO4的实验室制备设计路线如图:下列有关说法正确的是( )
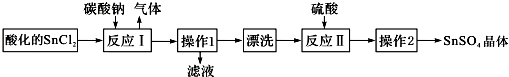

| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+═CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次 | |
| D. | 操作1为过滤,操作2为盐析 |
10.使用容量瓶配制溶液时,下列操作正确的是( )
| A. | 使用容量瓶前必须检查容量瓶是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 称好的固体试样需用纸条小心地送入容量瓶中 | |
| D. | 摇匀后发现凹液面下降,再加水至刻度线 |
17.下列分子中,立体构型是平面三角形的是( )
| A. | CH4 | B. | NH3 | C. | BF3 | D. | SO3 |
14.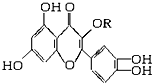 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 | |
| B. | 1mol OH-和1mol-OH (羟基)中含有的质子数均为9NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |